
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:不详 题型:填空题
 2)若将二氧化硫通入H2SeO3的溶液中,会有Se析出,写出该反应的化学方程式:
2)若将二氧化硫通入H2SeO3的溶液中,会有Se析出,写出该反应的化学方程式: ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 入新制的氯水,溶液变红
入新制的氯水,溶液变红

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用“绿色化学”工艺,使原料完全转化为产物 |
| B.推广燃煤脱硫技术,防治SO2污染 |
| C.推广垃圾的分类存放、回收、处理 |
| D.大量使用农药化肥提高粮食产量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (3)合成氨的反应N2(g)+3H2(g)
(3)合成氨的反应N2(g)+3H2(g) 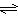 2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92.4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。 (4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.36% | B.46% | C.53% | D.22% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
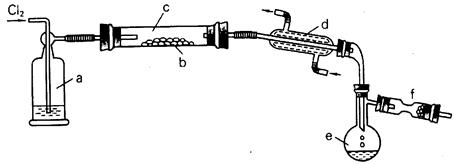
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com