
【题目】已知某元素的阳离子R2+的核内中子数为N,质量数为A,则1mol它的氧化物中所含电子的物质的量是( )
A. (A-N+8)molB. (A-N+10)mol
C. (A-N+2)molD. (A-N+6)mol
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列除杂的操作方法,正确的是( )
A. NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶
B. CO2中混有少量SO2气体:通入NaOH溶液
C. 食盐固体中混有少量NH4Cl:加热
D. 硝酸混有少量硫酸:加适量BaCl2溶液后再过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=2的无色溶液中能大量共存的离子组是
A. Na+、K+、HSO3-、NO3- B. Mg2+、ClO-、Na+、Cl-
C. NH4+、Al3+、SO42-、Br- D. MnO4-、NO3-、Ca2+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 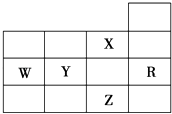
A.W元素的第一电离能小于Y元素的第一电离能
B.Y,Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题: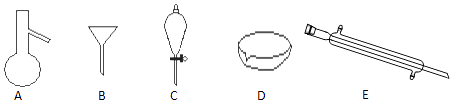
(1)写出仪器A、C、E的名称
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精: 汽油和水: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )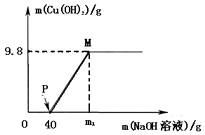
A.整个反应过程中,氯离子个数不变
B.M点溶液中的溶质有一种
C.P点溶液比M点溶液中氯化钠的质量分数大
D.沉沉完全时,m1的数值为120
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)NaOH的电子式为 .
(2)工业上常用焦炭还原二氧化硅制备粗硅,用化学方程式表示 .
(3)FeSO4溶液与稍过量的NH4HCO3溶液混合,有FeCO3白色沉淀生成和明显的无色气泡现象,写出相关离子方程式 .
(4)完成以下氧化还原反应的离子方程式:
() Cr2O2﹣7+() H2O2+()═() Cr3++()H2O+() .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A最多可以与两倍于其物质的量的H2加成。当烃A与足量HCl加成后产物为B,B与四倍于其物质的量的Cl2反应才能得到完全卤代的产物。烃A是( )
A.CH2===CH—CH===CH2
B.CH≡CH
C.CH3CCH
D.CH2===CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要. 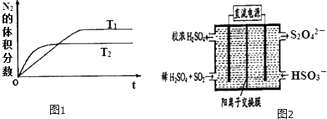
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放.
①在T1、T2温度下,一定量的NH3发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+3H2(g)═2NH3(g)的△H0(填“>”或“<”).
②在T3温度下,向2L密闭容器中充入10molN2与5mo1H2 , 50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2) . 该温度下,若增大压强此反应的平衡常数将(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10mol,则达到平衡后H2的转化率将 . (填“升高”、“降低”)
(2)利用图2所示装置(电极均为惰性电极)可吸收SO2 , 用阴极排出的溶液可吸收NO2 .
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO32﹣生成.该反应的离子方程式为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a molL﹣1的醋酸与b mol﹣L﹣1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka=(用含a和b的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com