
电解水﹙H2O﹚和重水﹙D2O﹚的混合物,通电一定时间后,两极共生成气体18.5克,体积为33.6L﹙标况﹚,所生成的气体中重氢﹙D﹚和普氢﹙H﹚的原子个数比是( )
A. 1:1 B.1:2 C.1:3 D. 1:4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH— Fe3O4+S4O62-+2H2O下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=6
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关系中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
A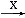 B
B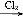 C
C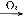 D
D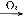 E
E F
F
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B与Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
能正确表示下列化学反应的离子方程式是 ( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D.碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列各组离子在指定的溶液中一定不能大量共存的是
A.使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2-、Cl-
B.1mol•L-1的烧碱溶液中:S2-、SO32-、K+、SO42-
C.滴人NH4SCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl-
D.含有大量HCO3-的澄清透明溶液中:K+、NH4+、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第三次月考化学试卷(解析版) 题型:选择题
近年来科学家制造出大量的新物质,对下列三种物质的相关说法的不正确的是
A.石墨烯具有良好的导电性
B.上述三种物质与金刚石互为同素异形体
C.石墨炔孔径略大于氢气分子的直径,可作压的提纯氢气薄膜
D.上述三种物质与浓硫酸都能发生反应,但反应产物不同
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.lmolFeI2与足量氯气反应时转移的电子数为2NA
B.标准状况下,22.4LSO3含有NA个SO3分子
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 1mol FeCl3完全水解生成NA个胶体粒子
B. 常温常压下,23g NO2分子总数小于0.5NA
C. 标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D. 6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三上12月月考理综化学试卷(解析版) 题型:填空题
Ⅰ、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2中c(NH)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH)。
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
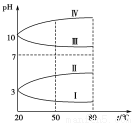
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________,导致pH随温度变化的原因是__________________________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:
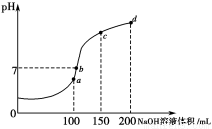
试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________________
Ⅱ、为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
(1)写出步骤2中溶液变红色的离子方程式 。
(2)步骤3中现象a 。
(3)用化学平衡原理解释步骤4的实验现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com