
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
25.(1) ① 偏大 (2)无色 浅红色 (3) 22.60 毫升 (4)0.2000mol/L
【解析】
试题分析:(1)①用蒸馏水洗涤碱式滴定管后,不能立即注入NaOH溶液,应先用NaOH溶液润洗;否则所用NaOH溶液的体积偏大,导致测定盐酸的浓度偏大;(2)酚酞试剂在酸性溶液中呈无色,当溶液呈弱碱性时,溶液呈粉红色,所以判断滴定终点的现象是:锥形瓶中溶液从无色变为粉红色,且半分钟内不变色;(3)滴定管中的液面读数为22.60mL,答案为:22.60;
(4)三次滴定消耗的体积为:20.00mL,20.00mL,22.10,舍去第3组数据,然后求出1、2组平均消耗V(NaOH)=20.00mL,c(待测)=(V标?C标)/V待测=(0.2x20)/20=0.2000mol?L-1,答案为:0.2000.
考点:考查酸碱中和滴定。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列判断不合理的是( )
A.能电离出H+的物质一定是酸
B.焰色反应是物理变化
C.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D.蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
一定条件下,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1。现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热ΔH如表所示:
2SO3(g) ΔH=-197 kJ·mol-1。现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热ΔH如表所示:

根据以上数据,下列选项正确的是
A.ΔH1=2ΔH2 B.ΔH3<ΔH4 C.ΔH1+ΔH5=197 D.ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是________________;(填编号)
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_____;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是__________________,

稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”),理由是:__________________;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________。(填准确数值)
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
在容积固定为4L的密闭容器中,进行了可逆反应:X(g)+2Y(g)  2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示
2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示

A.X浓度的减少
B.X物质的量的减少
C.Z浓度的增加
D.Y物质的量的减少
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.有人利用ZrO2作为固体电解质(允许O2-通过)制造出了常温下的甲醇一空气燃料电池。当原电池中有0.5 mol甲醇消耗时,则负极消耗O2—的物质的量为1.5mol
B.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为 g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=(17V+22400)/(22.4+22.4V)g/ml
g/ml,质量分数为ω,物质浓度为c mol/L,则ρ=(17V+22400)/(22.4+22.4V)g/ml
C.已知常温下,氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中C(OH-)=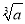 mol/L
mol/L
D.将11.2g的Mg和Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。 再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是0.2mol NO2和0.1mol N2O4
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供。因其独特的放电方式,也称呼吸式电池。负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液。中间设有用于隔开正极和负极的锂离子固体电解质。正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合。如图所示。下列说法不正确的是
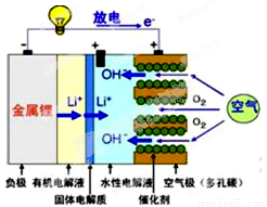
A.负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形 式溶于有机电解液,电子供应给导线。溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中。
B.正极反应:O2+2H2O+4e- =4OH- ,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环。
C.在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应。
D.锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com