解:短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X
2、Z
2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H
2、Cl
2单质及NaOH,H
2与Cl
2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X
2 为H
2,Z
2为Cl
2,次氯酸钠能与HCl反应生成氯气.故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X
2 为H
2,Z
2为Cl
2,B为HCl,C为NaOH,D为NaClO,
(1)Y为钠元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族,
故答案为:第三周期,第IA族;
(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,
反应的化学方程式为2NaCl+2H
2O

2NaOH+Cl
2↑+H
2↑,
故答案为:2NaCl+2H
2O

2NaOH+Cl
2↑+H
2↑;
(3)D为NaClO,为强碱弱酸盐,溶液中发生ClO
-+H
2O?HClO+OH
-,呈碱性,
故答案为:ClO
-+H
2O?HClO+OH
-;
I、反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO
-+Cl
-+2H
+=Cl
2↑+H
2O故答案为:ClO
-+Cl
-+2H
+=Cl
2↑+H
2O;
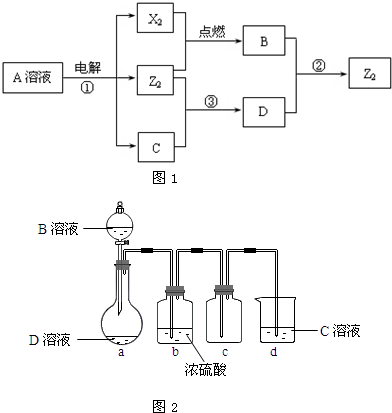
II、由于盐酸具有挥发性,上述实验装置制取的氯气中含有氯化氢,应在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl,
故答案为:在a、b装置之间加一盛有饱和食盐水(或水)的洗气瓶,除去HCl.
分析:短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X
2、Z
2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H
2、Cl
2单质及NaOH,H
2与Cl
2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X
2 为H
2,Z
2为Cl
2,次氯酸钠能与HCl反应生成氯气.故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X
2 为H
2,Z
2为Cl
2,B为HCl,C为NaOH,D为NaClO,结合对应物质的性质以及题目要求可解答该题.
点评:本题综合考查元素化合物的推断、电解、离子方程式、对实验装置的理解与评价等,难度中等,掌握电解原理推断元素及相应化合物是关键.

 2NaOH+Cl2↑+H2↑,
2NaOH+Cl2↑+H2↑, 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案