
【题目】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________,试管浸泡在50 ℃的水浴中,目的是___________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:A.3 mol·L-1H2SO4、B.6 mol·L-1NaOH、C.0.5 mol·L-1BaCl2、D.0.5 mol·L-1Ba(NO3)2、E.0.01 mol·L-1酸性KMnO4溶液。(填所选试剂的序号)
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入________ | ____________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
(4) 配平离子方程式,并在![]() 中填上所需的微粒:_______________________
中填上所需的微粒:_______________________
H++ MnO4-+ Fe2+→ Mn2+ Fe3++ ![]()
【答案】 防止溶液倒吸入装置Ⅰ 防止SO3液化或凝固 BaCl2溶液 KMnO4溶液 若溶液紫色褪去,证明气体产物中含有SO2;若溶液紫色无明显变化,证明气体产物中不含SO2; NaOH溶液 8,1,5,1,5,4,H2O
【解析】(1)Ⅰ中产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中,即起到安全瓶的作用;SO3的沸点是44.8°C,当温度高于44.8°C时SO3为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固;(2)FeSO4分解的气体产物可能为SO3,也可能为SO3和SO2的混合物,SO3溶于水生成硫酸,遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色,因此答案为:
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入KMnO4溶液 | 若溶液紫色褪去,证明气体产物中含有SO2;若溶液紫色无明显变化,证明气体产物中不含SO2 |
(3)可以用碱液吸收二氧化硫或三氧化硫,因此烧杯中应加入的试剂是NaOH溶液;(4)铁元素化合价从+2价升高到+3价,失去1个电子,Mn元素化合价从+7价降低到+2价,得到5个电子,根据电子得失守恒、电荷守恒以及原子守恒可知配平后的方程式为8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O。


科目:高中化学 来源: 题型:
【题目】某复合材料是由碳纤维为增强体、金属钛为基体复合而成的。估计这种材料( )
①耐高温 ②不耐热 ③导电、导热 ④不导电、不导热 ⑤可用于飞机机翼 ⑥可用于导弹的壳体
A.①③⑤⑥
B.②③⑤⑥
C.②③④
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组进行如下的实验,根据装置图回答下列问题:
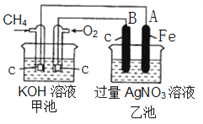
(1)通入CH4的电极的电极反应式是__________ ,A的电极反应式是______________ 。
(2)通电一段时间后,乙池中溶液的pH_________(填“升高”“降低”或“不变”),当乙池中某一电极质量增加 10.8g时,电路中有______ mol电子通过,理论上甲池中共消耗气体 _________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列综合开发利用海水资源的过程中,只发生物理变化的是( )
A. 用海水晒制食盐 B. 从海带中提取碘
C. 从海水中提取溴 D. 用海水制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示水解的离子方程式正确的是 ( )
A. NH4++H2O![]() NH4OH+H+ B. HCO3+H2O
NH4OH+H+ B. HCO3+H2O![]() H2CO3+OH
H2CO3+OH
C. S2+2H2O![]() H2S+2OH D. HCO3+H2O
H2S+2OH D. HCO3+H2O![]() H3O++CO32
H3O++CO32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 20 mL 0.1 mol·L-1 的 CH3COOH 溶液中不断滴入 0.1 mol·L-1 的 NaOH溶液,溶液的pH变化曲线,如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述错误的是
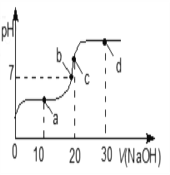
A. a 点时: c( CH3COO-)>c( Na+)>c( H+)>c( OH-)
B. b 点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C. c 点时:c(OH-)=c(CH3COOH) +c(H+)
D. d 点时:c(Na+)> c(OH-) > c(CH3COO-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯和乙烯都是石油化工最重要的基础原料,可用于生产多种重要的有机化工产品。主要的工业生产途径如下:
途径I:CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径II :nCH3OH(g) ![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=________ kJ·mol-1 。
(2)途径I制备丙烯,要提高丙烯的产率最好采用____________条件。(填“高压”或“低压”)
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是______________________。
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:_____________,CO32-移向电池的___极 (填“正”或“负”)。
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为_____L (标准状况下)。
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI﹣淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
已知:3I2+6OH﹣═IO3﹣+5I﹣+3H2O
回答下列问题:
(1)左侧为电源极.(填“正”或“负”)
(2)请用方程式及必要的文字解释左侧溶液变蓝色的原因? .
(3)写出右侧发生的有关电极反应的反应式: .
(4)电解反应结束时,左侧溶液中还I﹣ . (填“有”或“没有”)
(5)写出电解槽内发生反应的总化学方程式: .
(6)如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应 . (填“变”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com