
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
| A、比较等体积、等pH值的两种溶液的导电性 |
| B、比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C、比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D、比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3胶体和FeCl3溶液区别的本质特征为是否具有丁达尔效应 |
| B、FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷 |
| C、纳米材料的微粒直径一般从几纳米到几十纳米,因此纳米材料是胶体 |
| D、FeCl3溶液能使血液凝聚沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )| A、x与y的差值为0.01mol |
| B、原溶液中c(Cl-)=0.85mol?L-1 |
| C、原溶液的c(H+)=0.1mol?L-1 |
| D、原溶液中n(Mg2+):n(Al3+)=5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
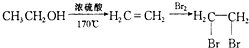
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B、反应物分子的能量增加,活化分子浓度增大,有效碰撞次数增多 |
| C、该化学反应的过程是吸热造成的 |
| D、该化学反应的过程是放热造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com