
【题目】苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g)△H
(1)已知:H2和CO的燃烧热(△H)分别为﹣285.8kJ.molL﹣1和﹣283.0kJ.molL﹣1;
C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(I)△H=+114.8kJmol﹣1
则制取苯乙烯反应的△H为
(2)向密闭容器中加入1mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ.下列说法正确的是 .
A.升高温度,正反应速率减小,逆反应速率增大
B.若继续加入1mol乙苯,苯乙烯转化率增大
C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小
D.相同条件下若起始加入1mol苯乙烯和1mol氢气,达平衡时反应能量变化为(△H﹣Q)kJ
(3)向2L密闭容器中加入1mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示.700℃时,乙苯的平衡转化率为 , 此温度下该反应的平衡常数为;温度高于970℃时,苯乙烯的产率不再增加,其原因可能是 .
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2 , 该阳极的电极反应式为 , 若去除0.5mol苯乙烯,两极共收集气体mol.
【答案】
(1)+117.6KJ/mol
(2)D
(3)66.7%;![]() ;有机化合物在温度过高时分解
;有机化合物在温度过高时分解
(4)C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣;14
【解析】解:(1)H2和CO的燃烧热(△H)分别为﹣285.8kJ.molL﹣1和﹣283.0kJ.molL﹣1 , 可得热化学方程式:①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8KJ/mol,②CO(g)+
O2(g)=H2O(l)△H=﹣285.8KJ/mol,②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0KJ/mol,已知③:C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,根据盖斯定律,③+②﹣①可得:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g),故△H=114.8KJ/mol﹣283.0KJ/mol+285.8KJ/mol=+117.6KJ/mol,所以答案是:+117.6KJ/mol;(2)A.温度变化对正逆反应速率的影响是一致的,只是改变的程度不同,所以升高温度,正反应速率和逆反应速率均增大,故A错误;B.若继续加入1mol乙苯,相当于增大整个体系的压强,增大压强,平衡逆向移动,故苯乙烯转化率增大,B正确;C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大,故C错误;D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,假设平衡时为amol乙苯,则原平衡反应中能量变化为QkJ=(1﹣a)×△H kJ,而生成amol乙苯的能量变化为:a×△H kJ=(△H﹣Q)kJ,故D正确;所以答案是:BD;(3)参加反应的乙苯为xmol,则:
O2(g)=CO2(g)△H=﹣283.0KJ/mol,已知③:C6H5CH2CH3(g)+CO2(g)C6H5CH=CH2(g)+CO(g)+H2O(l)△H=+114.8kJ/mol,根据盖斯定律,③+②﹣①可得:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g),故△H=114.8KJ/mol﹣283.0KJ/mol+285.8KJ/mol=+117.6KJ/mol,所以答案是:+117.6KJ/mol;(2)A.温度变化对正逆反应速率的影响是一致的,只是改变的程度不同,所以升高温度,正反应速率和逆反应速率均增大,故A错误;B.若继续加入1mol乙苯,相当于增大整个体系的压强,增大压强,平衡逆向移动,故苯乙烯转化率增大,B正确;C.压缩容器的体积,增大体系的压强,平衡向气体体积减小的方向移动,乙苯的浓度增大,平衡常数不变,故平衡时苯乙烯、氢气的浓度也增大,故C错误;D.相同条件下若起始加入1mol苯乙烯和1mol氢气,等效为开始加入1mol乙苯,与原平衡为完全等效平衡,平衡时乙苯的物质的量相等,假设平衡时为amol乙苯,则原平衡反应中能量变化为QkJ=(1﹣a)×△H kJ,而生成amol乙苯的能量变化为:a×△H kJ=(△H﹣Q)kJ,故D正确;所以答案是:BD;(3)参加反应的乙苯为xmol,则:
C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):x x x
平衡量(mol):1﹣x x x
由图示可知:700℃时,乙苯的物质的量百分含量为20%,则 ![]() =20%,所以x=
=20%,所以x= ![]() ,乙苯的平衡转化率为
,乙苯的平衡转化率为 ![]() ×100%=66.7%,
×100%=66.7%,
此温度下平衡常数K= ![]() =
= ![]() =
= ![]() ,
,
温度高于970℃时,苯乙烯的产率不再增加,可能有机物受热易分解是所致;
所以答案是:66.7%; ![]() ;有机化合物在温度过高时分解;(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH﹣ 离子生成,由元素守恒可知,应有水参与反应,阳极电极反应式为:C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣ , 阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e﹣=H2↑+2OH﹣ ,
;有机化合物在温度过高时分解;(4)由题目信息可知,阳极上整个过程是苯乙烯氧化生成二氧化碳,由守恒守恒可知,应有OH﹣ 离子生成,由元素守恒可知,应有水参与反应,阳极电极反应式为:C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣ , 阴极上是氢离子获得电子生成氢气,阴极电极反应式为:2H2O+2e﹣=H2↑+2OH﹣ ,
除去0.5mol苯乙烯,则:
C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣
0.5mol 20mol 4mol
2 H2O+2 e﹣=H2↑+2OH﹣
20mol 10mol
故两极共收集气体:4mol+10mol=14mol,
所以答案是:C6H5CH=CH2+16H2O﹣40e﹣=8CO2↑+4OH﹣;14.
【考点精析】通过灵活运用化学平衡状态本质及特征和化学平衡的计算,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】按要求填空
(1)![]() O、
O、![]() O、H、H四种核素最多可以组成 ______ 种水分子。
O、H、H四种核素最多可以组成 ______ 种水分子。
(2)24g 12C18O2 分子含有中子______mol,质子数为__________;画出CO2的电子式:__________.
(3)请画出![]() O2-微粒的结构示意图: ______ .
O2-微粒的结构示意图: ______ .
(4)工业上可由N2和H2合成NH3.已知该反应为放热反应. 写出NH3的结构式______。写出该反应的化学方程式 ______ .
(5)下列反应中,属于放热反应的是______,属于吸热反应的是______.
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③炸药爆炸
④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰
⑥Ba(OH)28H2O晶体与NH4Cl晶体的反应 ⑦灼热的木炭与CO2反应
写出Ba(OH)28H2O晶体与NH4Cl晶体反应的化学反应方程式:_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的“衣食住行“,休戚相关.
(1)①材料是人类赖以生存的重要物质基础.合金是被广泛应用的金属材料.钢属于(填“铁合金”或“铝合金”);铁锈蚀主要发生的是电化学腐蚀,其负极反应式为;无机非金属材料包括玻璃、水泥和 . ②真丝织品与化纤织品是生活中最常用的面料,下列有关说法不正确的是 .
A.真丝织品中主要含有C,H,O,N四种元素
B.可以用燃烧的方法来区分
C.化纤织品中成分遇到重金属盐,强酸,强碱,有机物等会产生沉淀而失去活性
D.两种产品都属于高分子材料
(2)①我国居民一般尿液偏酸性,平时饮食中应多吃(填”肉类”,”几鸡蛋”,”水果”)等碱性食物;微量元素与人体健康密切相关,为了预防碘缺乏,启动了”食盐加碘”,就是在食盐中加适量的 . 如治疗缺铁性贫血可服用”亚铁丸”(内含有FeSO4 , 外面裹了一层糖衣),试设计实验判断该亚铁丸是否质 . ②服药时要对症下药,胃舒平(主要成分Al(OH)3)适用于治疗(填”感冒发热”,”细菌感染”,”胃酸过多”).解热镇痛药阿司匹林的结构式为 ![]()
请你写出其中含有的一个官能团的名称 .
(3)①汽车尾气(主要有NO等物质)是城市的污染源.治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂.钯合金作催化剂).它的特点是使CO与NO反应,生成无毒气体.写出CO与NO反应的化学方程式: . ②获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉进行杀菌消毒,其原理可用化学方程式表示为
③奥运期间使用了全生物降解塑料袋,用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等,这是为了防止(填写环境术语).“鸟巢”体育场内,各区座位席的通道口设有专门垃圾箱,箱体上分别用绿色和黑色字样标有“可回收物”和“其他垃圾”,如图图标表示 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸、硝酸与盐酸是工业上常用的三大强酸。工业上制备硫酸常用接触法,工业上制硝酸是用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 氨被氧气催化氧化:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 接触法制硫酸的原料为:二氧化硫、空气、水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )

选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++SO ![]() +H++OH﹣═BaSO4↓+H2O
+H++OH﹣═BaSO4↓+H2O
B.淀粉碘化钾溶液在空气中变蓝:4I﹣+O2+2H2O═4OH﹣+2I2
C.向Na2SO3溶液中滴加稀硝酸:SO ![]() +2H+═SO2↑+H2O
+2H+═SO2↑+H2O
D.用氨水吸收足量的CO2气体:OH﹣+CO2═HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的四个原电池装置,其中结论正确的是( ) 
A.①中Mg作负极,电子流向:Mg→稀硫酸→Al
B.②中Al作负极,OH迁移方向:Al→外电路→Mg
C.③中Fe作正极,电极反应式:2H++2e═H2↑
D.④中Cu作正极,电极反应式:O2+4e+2H2O═4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,能大量共存的离子组是
A. Mg2+、Na+、SO42-、Cl- B. Al3+、Ag+、NO3-、Cl-
C. Cu2+、Cl-、NO3-、OH- D. K+、H+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
元素 | Mn | Fe | |
电离能/kJmol﹣1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素价电子层的电子排布式为 , 比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是 .
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 , 其中体心立方晶胞空间利用率为 . 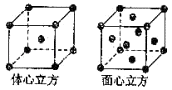
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com