
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期中原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题。
(1)元素D在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________________。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
②若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________________________________________________________。
③FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式________________________________________________________________________。
(1)第三周期 ⅠA族 (2)S2->O2->Na+
(3)离子键、共价键、配位键(配位键不写不扣分)
(4)①2Al+Fe2O3 Al2O3+2Fe ②SiO2+2OH-=SiO32-+H2O ③2SO2+O2+2H2O=2H2SO4
Al2O3+2Fe ②SiO2+2OH-=SiO32-+H2O ③2SO2+O2+2H2O=2H2SO4
解析试题分析:原子最外层电子数是次外层电子数三倍的元素为氧元素,即C为O,则F为S;D与F同周期且其在该周期中原子半径最大,则D为Na,A为H;B的原子序数比A大比C小,其单质为气体,则B为N;E的原子序数间于Na和S之间,可能为Mg、Al、Si、P。(1)D为Na,则其在元素周期表中的位置为:第3周期I A族。(2)C、D、F三种元素形成的简单离子为:O2–、Na+、S2–,O2–与Na+具有相同的电子层结构,Na+核电荷数比O2–大,所以Na+半径比O2–小,而S2–、O2–同主族,S2–核外三层电子,O2–核外两电子,所以S2–半径比O2–大,故离子半径大小顺序为:S2–>O2–>Na+。(3)A、B、C三种元素以原子个数比4∶2∶3形成化合物为NH4NO3,NH4NO3中的化学键为离子键和共价键。(4)①若E是金属元素,其单质又能与氧化铁反应常用于焊接钢轨,则E为Al,反应的化学方程式:2Al+Fe2O3 Al2O3+2Fe;②若E是非金属元素,其单质在电子工业中有重要应用,则E可为Si,其氧化物溶于强碱溶液的离子方程式:SiO2+2OH-=SiO32-+H2O;③FC2气体有毒,排放到大气中易形成酸雨,则FC2为SO2,SO2与氧气和水蒸气反应的化学方程式为:2SO2+O2+2H2O=2H2SO4。
Al2O3+2Fe;②若E是非金属元素,其单质在电子工业中有重要应用,则E可为Si,其氧化物溶于强碱溶液的离子方程式:SiO2+2OH-=SiO32-+H2O;③FC2气体有毒,排放到大气中易形成酸雨,则FC2为SO2,SO2与氧气和水蒸气反应的化学方程式为:2SO2+O2+2H2O=2H2SO4。
考点:元素周期律、元素周期表中元素位置的确定、化学键、化学方程式书写等内容。
考点:考查


科目:高中化学 来源: 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在元素周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成______________外,也生成微量的________________。
(2)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇足量强碱溶液反应的离子方程式为_____________________________________________________________。
(3)科学家证实,BeCl2是共价化合物,可以设计一个简单实验证明,该实验方法是:____________________________________________________________________________。
用电子式表示BeCl2的形成过程:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题: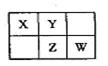
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3) AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是___ _。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是元素周期表的框架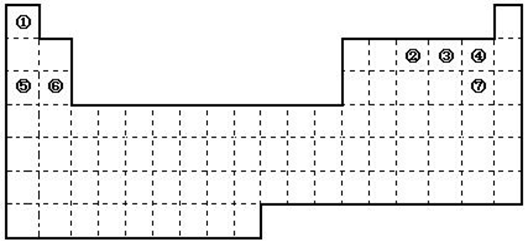
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某短周期主族元素的原子M层上有一个半充满的亚层,这种原子的质子数是 ___________,写出它的外围电子排布图___________。
(2)VIA族的.硒(Se).在化合物中常表现出多种氧化态, H2SeO4比H2SeO3酸性_-___( 填强或弱),H2Se的酸性比H2S__________(填“强”或“弱”)。
(3)固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔、沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.0.1 mol NH5中含有5 mol N—H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F周表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| A | A是周期表中原子半径最小的元素 |
| B | B元素的原子价电子排布为ns11np14 |
| C | M的基态原子L层电子数是K层电子数的3倍 |
| D | D是第三周期中第一电离能最小的元素 |
| E | E是地壳中含量最多的金属元素 |
| F | 有多种化合价,其某种高价阳离子的价电子具有较稳定的半充满结构 |
 键与
键与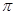 键与个数之比为 ;
键与个数之比为 ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com