
| A. | 单位时间内生成n mol X,同时消耗3n molY | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的物质的量分数均保持不变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.单位时间内生成3nmolX同时消耗nmolY时,该反应达到平衡状态,当单位时间内生成n mol X、同时消耗3n molY时该反应没有达到平衡状态,故A错误;
B.X的生成速率与Z的生成速率之比为3:2时该反应达到平衡状态,当X的生成速率等于Z的生成速率时该反应没有达到平衡状态,故B错误;
C.X、Y、Z的物质的量分数均保持不变,说明正逆反应速率相等,该反应达到平衡状态,故C正确;
D.X、Y、Z的分子个数比为3:1:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始物质的量及转化率有关,故D错误;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
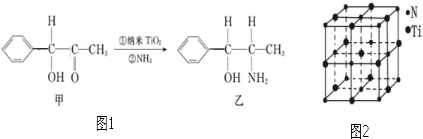
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
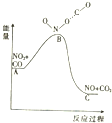
| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
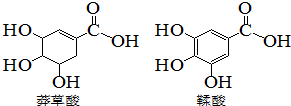 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ | |
| D. | C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
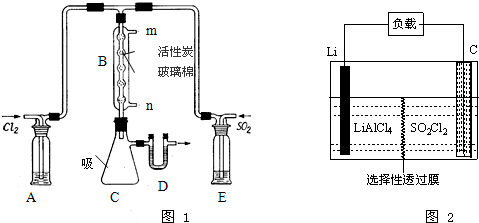
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用工业废水直接灌溉农田 | B. | 用可降解塑料做购物袋 | ||
| C. | 将煤气化或液化获得清洁燃料 | D. | 火力发电厂的燃煤中加适量石灰石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com