
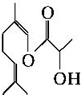
| A. | 1 mol该化合物最多可与2 mol H2反应 | |
| B. | 该化合物能与乳酸发生酯化反应 | |
| C. | 该化合物能与氢氧化钠溶液、溴水反应 | |
| D. | 该化合物的同分异构体可能为芳香族化合物 |
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径在10-9~l0-7m之间 | B. | 是一种纯净物 | ||
| C. | 具有丁达尔效应 | D. | 具有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个用铂丝作电极,电解Na2SO4溶液的装置,电解液中加有酚酞.闭合开关,电解一段时间后发现:a、b试管中产生气体的体积比为2:1.
如图是一个用铂丝作电极,电解Na2SO4溶液的装置,电解液中加有酚酞.闭合开关,电解一段时间后发现:a、b试管中产生气体的体积比为2:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子的还原性:C2-<D- | ||
| C. | 氢化物的稳定性:H2C>HD | D. | 离子半径:B+>A3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径/10-10 m | 0.74 | 0.77 | 1.52 | 1.02 | 1.10 | 0.71 | 1.86 | 0.75 | 0.99 |
| 最高化合价 | - | +4 | +1 | +6 | +5 | - | +1 | +5 | +7 |
| 最低化合价 | -2 | -4 | - | -2 | -3 | -1 | - | -3 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用不同 | |
| D. | 短周期元素离子aXn-和bYm-具有相同的电子层结构,若a>b,则n>m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氢分子的质量与氢气的摩尔质量在数值上相等 | |
| B. | NA个氢气分子和NA个氯气分子的质量之比1:1 | |
| C. | 16g氧气所含氧分子数目为NA | |
| D. | 44gCO2与44gCO所含的分子数目均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com