
��2012?�Ϻ���ͼ��ʾ����֤�������ʵ���ʵ�飬a��b��d��e�ǽ��������Һ����ֽ����KMnO4����μ�һ��Ũ�������������һ������������森��֪��2KMnO4+16HCl��2KCl+5Cl2��+2MnCl2+8H2O ��ʵ������ġ����ͻ���ۡ���ȷ���ǣ�������
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?�Ϻ�����ͼװ���з�����Ӧ�����ӷ���ʽΪ��Zn+2H+�TZn2++H2��������˵��������ǣ�������
��2012?�Ϻ�����ͼװ���з�����Ӧ�����ӷ���ʽΪ��Zn+2H+�TZn2++H2��������˵��������ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?�Ϻ�ģ�⣩������ͼװ��̽�����ں�ˮ�еĵ绯ѧ����������˵������ȷ���ǣ�������
��2012?�Ϻ�ģ�⣩������ͼװ��̽�����ں�ˮ�еĵ绯ѧ����������˵������ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| 1 | 10 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
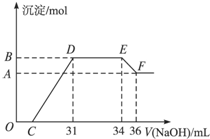 ��2012?�Ϻ�ģ�⣩ijͬѧȡһ������Al��Fe���������2.0L��ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4mol/L������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��2012?�Ϻ�ģ�⣩ijͬѧȡһ������Al��Fe���������2.0L��ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4mol/L������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com