
����Ŀ��(1)�ӷ�ˮ�л��ձ��ӵķ����ǣ���ȡ�л��ܼ���ȡ��Һ�еı��ӣ��ڼ���ij��ҩƷ��ˮ��Һʹ���Ӵ��л��ܼ������룻��ͨ��CO2���������ӡ���д���ڡ��۲��Ļ�ѧ����ʽ___��___��
(2)ijȩ�Ľṹ��ʽΪ �����������ȩ�������õ��Լ���__����ѧ����ʽΪ___��
�����������ȩ�������õ��Լ���__����ѧ����ʽΪ___��
(3)ij������2��3��������1����ϩ��Ϊͬ���칹�壬������̼ԭ�Ӵ���ͬһƽ�棬д�������ʵĽṹ��ʽ__��
(4)ʵ�������ұ���ȡ���屽��ϩ�����Ⱦ�������Ӧ�Ƶ��м���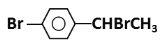 ��д����������Ӧ������Լ�������___��___��
��д����������Ӧ������Լ�������___��___��
���𰸡� +NaOH
+NaOH +H2O
+H2O  +CO2+H2O
+CO2+H2O![]() +NaHCO3 ϡ��ˮ��AgNO3��Һ������Cu(OH)2
+NaHCO3 ϡ��ˮ��AgNO3��Һ������Cu(OH)2  +2Ag(NH3)2OH
+2Ag(NH3)2OH +2Ag��+3NH3+H2O��
+2Ag��+3NH3+H2O�� +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH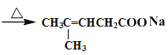 +Cu2O��+3H2O
+Cu2O��+3H2O  Һ���Fe������ ����������
Һ���Fe������ ����������
��������
(1)����NaOH���Ժͱ��ӷ�Ӧ���ɿ�����ˮ�ı����ƣ���ѧ����ʽΪ +NaOH
+NaOH +H2O��������������̼��ǿ��̼�����������ͨ�������̼�����뱽���Ʒ�Ӧ���ɱ��Ӻ�̼�����ƣ���ѧ����ʽΪ
+H2O��������������̼��ǿ��̼�����������ͨ�������̼�����뱽���Ʒ�Ӧ���ɱ��Ӻ�̼�����ƣ���ѧ����ʽΪ +CO2+H2O
+CO2+H2O![]() +NaHCO3��
+NaHCO3��
(2)ȩ�����Է���������Ӧ�����Ժ�����������ͭ����Һ���Ȳ���ש��ɫ���������Կ�����ϡ��ˮ��AgNO3��Һ������Cu(OH)2����ȩ������Ӧ�Ļ�ѧ����ʽΪ +2Ag(NH3)2OH
+2Ag(NH3)2OH +2Ag��+3NH3+H2O��
+2Ag��+3NH3+H2O�� +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH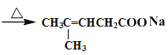 +Cu2O��+3H2O��
+Cu2O��+3H2O��
(3)2��3��������1����ϩ�Ľṹ��ʽΪ ������ͬ���칹������̼ԭ�Ӵ���ͬһƽ�棬���ǵ�̼̼˫��Ϊƽ��ṹ����֪��ӦΪ
������ͬ���칹������̼ԭ�Ӵ���ͬһƽ�棬���ǵ�̼̼˫��Ϊƽ��ṹ����֪��ӦΪ ��
��
(4)ʵ�������ұ���ȡ ����Ҫ����Һ����Fe(��FeBr3)�����������������ɶ����ұ���֮����������������������
����Ҫ����Һ����Fe(��FeBr3)�����������������ɶ����ұ���֮���������������������� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵������ȷ���м��
��lmolCl2��������ʱ�õ��ĵ���ЧΪ2NA
��25��ʱ��1LpH=12��̼������Һ�к���Na+����ĿΪ0.02NA
������������ˮ��Ӧʱ������0.5molO2ת�Ƶĵ�����Ϊ2NA
��50mL18.4mol/L��Ũ������������ͭ�Ⱥ�Ӧ������SO2������С��0.46NA
���������������������һ��pH�·�Ӧ���Ʊ������������ᣨ�ṹ��ͼ������ԭ����ȫ��Ӧ���õ�1mol����ͬʱ����3NA��H2O

A. 0 B. 1 C. 2 D. 3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֳ����ķǽ���Ԫ��A��B���볣�������ֽ���Ԫ��C��D��E��A��һ�ֵ�������Ȼ��Ӳ���������ʣ�B��C�ĵ����ڼ��������·�Ӧ���ɵ���ɫ������X��D�ĵ��ʼ��������ᣬҲ����NaOH��Һ��Ӧ����![]() ��E�ĵ�����B�ĵ�����ȼ�ջ����Ľ�������һ�ֺ�ɫ����Y����ش��������⣺
��E�ĵ�����B�ĵ�����ȼ�ջ����Ľ�������һ�ֺ�ɫ����Y����ش��������⣺
![]() ����X������______��
����X������______��
![]() ��D�ĵ�����ɰֽ��ĥ��Ȼ�����գ�Һ̬��D���������ԭ��______��
��D�ĵ�����ɰֽ��ĥ��Ȼ�����գ�Һ̬��D���������ԭ��______��
![]() д��E�ĵ�����ˮ������Ӧ�Ļ�ѧ����ʽ______��
д��E�ĵ�����ˮ������Ӧ�Ļ�ѧ����ʽ______��
![]() gC�ĵ���Ͷ������
gC�ĵ���Ͷ������![]() ��Һ�У�����ʵ��������ȷ����______��
��Һ�У�����ʵ��������ȷ����______��
A.�Ƴ�����Һ�ײ�
B.�ۻ�����ɫ������С��
C.С���Ĵ��ζ�������˻˻��������
D.���ɺ�ɫ��������
![]() ��
��![]() �п��ܵ����ӷ���ʽΪ______�������ó������ˡ�ϴ�ӡ�����ɵõ�______g���塣
�п��ܵ����ӷ���ʽΪ______�������ó������ˡ�ϴ�ӡ�����ɵõ�______g���塣
![]() ������
������![]() ��ȼ�գ����û�������ڱ���µ�ƽ��Ħ������Ϊ
��ȼ�գ����û�������ڱ���µ�ƽ��Ħ������Ϊ![]() ����A��
����A��![]() �����ʵ���֮��Ϊ______��
�����ʵ���֮��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�㷺��ij��������Ҫ�ɷ���NiFe2O4(������)��NiO��FeO��CaO��SiO2�ȣ�����ͼ�ǴӸÿ����л���NiSO4�Ĺ���·�ߣ�
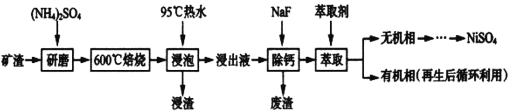
��֪��(NH4)2SO4��350�����ϻ�ֽ�����NH3��H2SO4��NiFe2O4�ڱ��չ���������NiSO4��Fe2(SO4)3����(Sn)λ�ڵ������ڵ�IVA�塣
��1������ǰ��������(NH4)2SO4�����ĥ�������ĥ��Ŀ����_______________��
��2�������ݡ�������Fe2(SO4)3����FeO(OH)�����ӷ���ʽΪ_________________________�����������ijɷֳ�Fe2O3��FeO(OH)�����___________________(�ѧʽ)��
��3��Ϊ��֤��Ʒ���ȣ�Ҫ��⡰����Һ������������ȡһ������Ľ���Һ���������ữ����SnCl2����Fe3+��ԭΪFe2+������SnC12�����ʵ���������Fe3+���ʵ�����_____������ȥ������SnCl2����������K2Cr2O7����Һ�ζ���Һ�е�Fe2+����ԭ����ΪCr3+���ζ�ʱ��Ӧ�����ӷ���ʽΪ_________________________________________��
��4��������Һ����c(Ca2+)=1.0��10-3mol��L-1���������ʴﵽ99��ʱ����Һ��c(F-)=___mol�� L-1��[��֪KSP(CaF2)=4.0��10-11]
��5����֪��ʮ����������ù��յ���ȡ�����õ绯ѧ�Ʊ���ʮ����ķ���Ϊ�����ձ��м���50mL�״������Ͻ���������������ƣ��ټ���11mL�����������ȣ�װ�ò��缫����ͨ��Դ��Ӧ�����������Լ�Сʱ�жϵ�Դ��Ȼ���ᴿ��ʮ���顣��֪����ܷ�ӦΪ��2C6H13COONa+2CH3OH![]() C12H26+2CO2��+H2��+2CH3ONa���������ĵ缫��ӦʽΪ______________________________________
C12H26+2CO2��+H2��+2CH3ONa���������ĵ缫��ӦʽΪ______________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������pH����ͬ�������AlCl3��Һ��ˮϡ��ʱ��pH�仯������ͼ�������й�˵����ȷ����( )
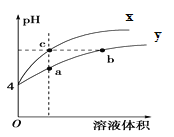
A.Al(OH)3�ĵ��뷽��ʽΪ��Al(OH)3��Al3+��3OH��
B.a����Һ���У� c(H��)��c(Al3+)��c(OH��) ��3c(Cl��)
C.����X��ʾ����ϡ���̵�pH�仯
D.b��c����Һc(OH��)��c(Cl��)�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.��״���£�11.2LSO3���е���ԭ�Ӹ���Ϊ1.5NA
B.100g34%��˫��ˮ�к���H��O������ĿΪ2NA
C.16.25gFeCl3ˮ���γɵ�Fe(OH)3����������Ϊ0.1NA
D.16.8gFe��������ˮ������ȫ��Ӧ��ת�Ƶĵ�����ĿΪ0.8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���ʵ����ʵ�ķ���ʽ����ȷ���ǣ� ��
A.��Na2S������Hg2+�ķ�ˮ��Hg2++S2��=HgS��
B.���ˮ�еμӱ����Ȼ�����Һ�õ����ɫҺ�壺FeCl3+3H2O=Fe(OH)3�����壩+3HCl
C.��Mg(OH)2����Һ�еμ�����FeCl3��Һ���ֺ��ɫ������3Mg(OH)2+2FeCl3��2Fe(OH)3+3MgCl2
D.Na2O2����H218O��2Na2O2+2H2l8O��4Na++4OH��+18O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����28.8gͭ��150mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ⣬������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش�
��1��NO�����Ϊ___L��NO2�����Ϊ___L��
��2��������������ȫ���ͷţ�����Һ�м���200mL5mol��L-1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ___mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ1 L���ܱ������У�1 mol X��1 mol Y���з�Ӧ��2X(g) ��Y(g)![]() Z(g)������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
Z(g)������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
A.X�İٷֺ������ٷ����仯
B.c(X)��c(Y)��c(Z)��2��1��1
C.������ԭ���������ٷ����仯
D.ͬһʱ��������2n mol X��ͬʱ����n mol Z
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com