
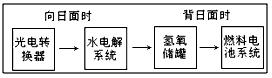
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:模拟题 题型:填空题
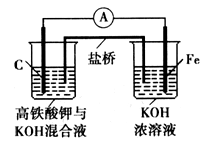
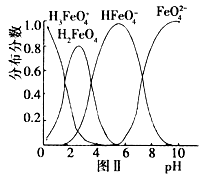
 4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。 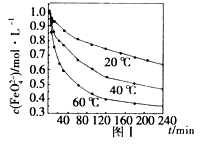
查看答案和解析>>
科目:高中化学 来源:江苏期中题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:0110 模拟题 题型:填空题
 CO(g)+2H2(g);△H= -36kJ/mol ①
CO(g)+2H2(g);△H= -36kJ/mol ①  CO(g)+3H2(g);△H= +216kJ/mol ②
CO(g)+3H2(g);△H= +216kJ/mol ②  CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为__________。
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为__________。 Na2FeO2+H2O+NH3↑ ①;
Na2FeO2+H2O+NH3↑ ①; 4Na2Fe2O4+3NH3↑ ②;
4Na2Fe2O4+3NH3↑ ②;
查看答案和解析>>
科目:高中化学 来源:0127 月考题 题型:填空题
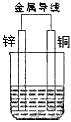
查看答案和解析>>
科目:高中化学 来源:0119 期末题 题型:不定项选择题
查看答案和解析>>
科目:高中化学 来源:江苏期末题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:江苏期中题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com