
分析 (1)电子层结构相同的离子,核电荷数越大离子半径越小;
(2)根据n=$\frac{m}{M}$计算2H2O和1H2O的物质的量之比,每个2H2O和1H2O分子 分别含有中子数为10、8,均含有10个电子,生成氢气的物质的量相等,转移电子数目相等,根据m=nM计算生成氢气质量之比.
解答 解:(1)An+、B(n+1)+、Cn-、D(n+1)-离子具有相同的电子层结构,则核电荷数B>A>C>D,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径为:r(D)>r(C)>r(A)>r(B),
故答案为:r(D)>r(C)>r(A)>r(B);
(2)根据n=$\frac{m}{M}$可知等质量的2H2O和1H2O的物质的量之比为18g/mol:20g/mol=9:10,每个2H2O和1H2O分子 分别含有中子数为10、8,则含有中子数之比为9×10:10×8=9:8,均含有10个电子,则含有电子数之比为9:10,二者生成氢气分别为2H2、1H2,二者物质的量相等,转移电子数目相等,即转移电子数目之比为:1,根据m=nM可知,生成氢气质量之比为4g/mol:2g/mol=2:1,
故答案为:9:8;9:10;2:1;1:1.
点评 本题考查物质的量计算、氧化还原反应计算、离子半径比较等,(2)中注意生成氢气的组成,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
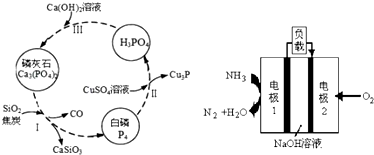
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
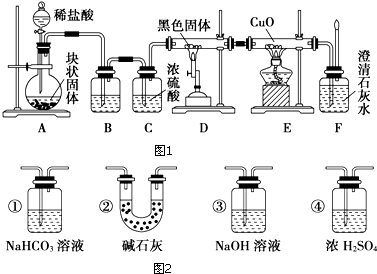
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
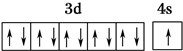 ,R在周期表中位于ds区.
,R在周期表中位于ds区.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
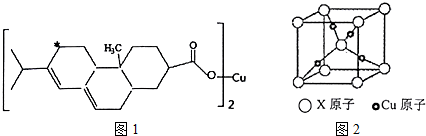
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 组成和结构信息 |
| a | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| b | 化学组成为BDF2 |
 ,其中B原子的杂化方式为sp2.
,其中B原子的杂化方式为sp2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
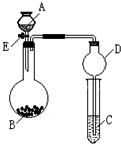 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com