

 .则:
.则: .
.| A→H | A→B | B→C | F→G | |
| 反应类型 |

 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$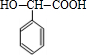 .
. 分析 苯乙烯发生聚合反应生成H,H的结构简式为 ,C的结构简式为
,C的结构简式为  ,可推知,A与溴发生加成反应生成B,故B为
,可推知,A与溴发生加成反应生成B,故B为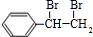 ,B发生水解得C,由G的结构简式可知,F发生缩聚反应生成G,故F为
,B发生水解得C,由G的结构简式可知,F发生缩聚反应生成G,故F为 ,由C的结构及转化关系可知,C氧化得D为
,由C的结构及转化关系可知,C氧化得D为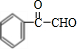 ,D氧化得E为
,D氧化得E为 ,E与氢气发生加成反应得F,据此解答.
,E与氢气发生加成反应得F,据此解答.
解答 解:苯乙烯发生聚合反应生成H,H的结构简式为 ,C的结构简式为
,C的结构简式为  ,可推知,A与溴发生加成反应生成B,故B为
,可推知,A与溴发生加成反应生成B,故B为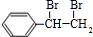 ,B发生水解得C,由G的结构简式可知,F发生缩聚反应生成G,故F为
,B发生水解得C,由G的结构简式可知,F发生缩聚反应生成G,故F为 ,由C的结构及转化关系可知,C氧化得D为
,由C的结构及转化关系可知,C氧化得D为 ,D氧化得E为
,D氧化得E为 ,E与氢气发生加成反应得F,
,E与氢气发生加成反应得F,
(1)由上面的分析可知,H的结构简式为 ,故答案为:
,故答案为: ;
;
(2)由上面的分析可知,反应过程的反应类型:
| A→H | A→B | B→C | F→G | |
| 反应类型 | 加聚反应 | 加成反应 | 取代反应 (或水解反应) | 缩聚反应 |
| A→H | A→B | B→C | F→G | |
| 反应类型 | 加聚反应 | 加成反应 | 取代反应 (或水解反应) | 缩聚反应 |
 ,反应的化学方程式为
,反应的化学方程式为 ,
, ;
;  +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ ,
, +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.点评 本题考查有机物的推断与合成,涉及烯烃、卤代烃、醇、醛、羧酸的性质等,掌握官能团的性质是关键,注意根据题目信息确定含有的官能团,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2+2HCl═CaCl2+H2O | |
| B. | 2NaHCO3+H2SO4═Na2SO4+2CO2↑+2H2O | |
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | |
| D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原气体一定含有NH3、NO、CO2 | |
| B. | 原气体一定不含HBr、NO2、H2 | |
| C. | 原气体中NO与CO2的体积比一定为3:2 | |
| D. | 原气体中NO与CO2的体积比一定为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 元素 | Mn | G | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25 NA | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com