
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。

已知:①SnCl2、SnCl4有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | ﹣33 | 114 |
②SnCl4极易水解生成SnO2H2O。
回答下列问题:
(1)导管a的作用是____________________________________________________________,装置A中发生反应的离子方程式为________________________________________。
(2)当观察到装置F液面上方______________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是____________________________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为____________________________________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________________________。
(5)滴定分析产品中2价Sn(II)的含量:用分析天平称取5.000 g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000 molL﹣1的碘标准溶液滴定至终点时消耗20.00 mL,则产品中Sn(II)的含量为____________________。
【答案】使分液漏斗内的液体顺利流下②防止氯气溢出污染空气 2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O 出现黄绿色气体 加快氯气与锡反应的速率②使SnCl4气化,利于其从混合物中分离出来 SnCl4+(+2)H2O=SnO2H2O+4HCl 控制Sn与氯气的反应温度控制在232℃至652℃之间②通入过量氯气 4.760%
【解析】
根据图示装置特点,分析装置的作用、制备流程和涉及的反应。
由装置图可知装置A应为制备氯气装置,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,B中试剂饱和食盐水除去HCl,可以降低氯气的溶解,C中试剂为浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在装置D中反应生成SnCl4,反应生成SnCl4,经冷却后在装置E中收集,未反应的氯气,用装置G吸收,为了防止尾气处理装置中水分进入装置E,在E和G之间用F装置干燥,以此解答该题;
(1)根据装置的特点及氯气的毒性分析,导管a的作用是:使分液漏斗内的液体顺利流下②防止氯气溢出污染空气;装置A是制备氯气,发生反应的离子方程式为:2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O ;
(2)为了排除装置中的空气,当观察到装置F液面上方出现黄绿色气体时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是:①加快氯气与锡反应的速率,②使SnCl4气化,利于其从混合物中分离出来;
(3)若上述装置中缺少装置C(其它均相同),则D中有水分,且由题干信息:SnCl4极易水解生成SnO2H2O,则发生的主要副反应化学方程式为:SnCl4+3H2O=SnO2H2O+4HCl;
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,根据表中给出的信息分析,为了保证Sn熔融,及确保两种化合物的分离,四氯化锡收集在E中,不让二氯化锡进入E中,二氯化锡不形成蒸气即可,可采取的措施是:①控制Sn与氯气的反应温度控制在232℃至652℃之间,②通入过量氯气;
(5)滴定反应中+2价Sn被碘氧化成+4价Sn,碘被还原成碘离子,根据电荷守恒得:n(I2)=n(Sn(II)),则产品中Sn(II)的质量为:119g/mol![]() 0.1000 molL﹣1
0.1000 molL﹣1![]() 0.02L=0.238g,则产品中Sn(II)的含量为0.238g/5g
0.02L=0.238g,则产品中Sn(II)的含量为0.238g/5g![]()


科目:高中化学 来源: 题型:
【题目】在实验室中模拟“侯氏制碱法”,其实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,一段时间后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体,进而生产出纯碱。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接_______,_______接______;b接_______(填接口序号)。
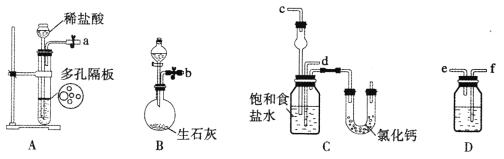
(2)A中常选用的固体反应物为_________;D中应选用的液体为____________。
(3)第二步中让___________装置先发生反应(填装置序号)。
(4)C中用球形干燥管而不用直导管,其作用是____________________;装有无水CaCl2的U形管的作用是__________________________。
(5)第三步分离出NaHCO3固体的操作是__________________________。
(6)第四步中所加固体粉末化学式为___________。所得的晶体中常含有少量的NaCl和NaHCO3(共约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_______>__________;________比较g、h的最高价氧化物对应水化物的酸性强弱:_______>__________。____________
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:____________________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:
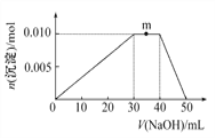
①写出m点反应的离子方程式:____________________________。
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
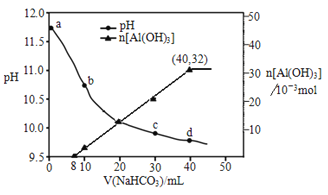
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )
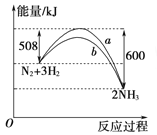
A. 该反应的热化学方程式:N2+3H2 = 2NH3ΔH=-92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应放出的热量增多
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com