
【题目】一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) ![]() C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是

A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通人B,则反应混合物的温度升高
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用可得到洁净的燃料和多种化工原料,也可减少环境呢污染。煤的间接液化可得到甲醇。
(1)已知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是____________。
(2)一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
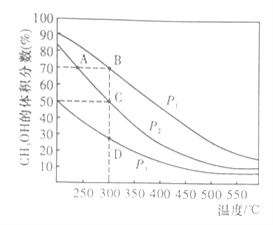
A、B、C三点平衡常数KA、KB、KC的大小关系是___________;压强:P1____P2(填“>”、“<”或“=”)
逆反应速率:v逆(A)______v逆(B)(填“>”、“<”或“=”)
在C点,CO的转化率为__________;
在C点,若再按物质的量之比1:2充入一定量的CO和H2,当其它条件不变,达到新的平衡时,CH3OH的体积分数__________(填“增大”、“减小”或“不变”)。
②若在恒温恒容条件下,能表示该可逆反应达到平衡状态的有__________。
A. 混合气体的密度保持不变
B. 混合气体的平均相对分子质量保持不变
C. 容器内的压强保持不变
D. 单位时间内每消耗1molCO的同时,生成2molH2
E. CO、H2、CH3OH的浓度保持不变
F. CO、H2、CH3OH的浓度之比为1:2:1
(3)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为________;常温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHS溶液的pH相比,pH较小的为______溶液(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如下图转化关系(部分反应物、生成物和反应条件略去)。下列推断不正确的是

A. 若D为白色沉淀,且与A的摩尔质置相等,则X—定是铝盐
B. 若A是单质,B和D的反应是OH-+HCO3-=H2O+HCO32-,则E—定能还原CuO
C. 若B、X均为单质,D为CO,C能和E反应,则E为NaOH
D. 若X是Na2SO3,C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法不正确的是( )
A. 硬铝比纯铝的硬度低 B. 合金中可以含有非金属元素
C. 青铜是一种铜锡合金 D. 储氢合金是一类能大量吸收H2成金属氢化物的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)![]() Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,![]() 减小,则△H________0(填“>”或“<”)。
减小,则△H________0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___________(填代号)
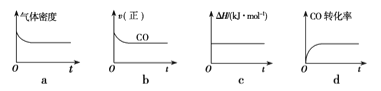
在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应 Fe(s) + CO2(g) ![]() FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.4 |
(1)若500℃时进行反应①,CO2的起始浓度为2mol﹒L-1,CO的平衡浓度为__________。
(2)该反应为__________(选填“吸热”或“放热”)反应。
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.CO2 C.升高温度到900℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合该反应的是__________(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
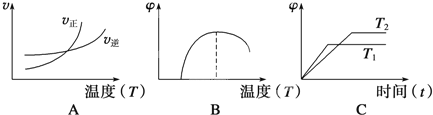
查看答案和解析>>
科目:高中化学 来源: 题型:
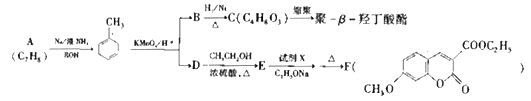
【题目】聚—β—羟丁酸酯是一种存在于许多细菌细胞质内属于类脂性质的碳源类贮藏物,不溶于水,而溶于氯仿。人工合成的聚—β—羟丁酸酯可制成易降解且无毒的医用塑料器皿和外科用的手术针和缝线。以A为原料合成聚—β—羟丁酸酯的路线如下图:
已知:①芳香环在钠的液氨溶液及醇作用下能够被还原成1,4一环已二烯;
②![]() =CHR3
=CHR3![]()
![]() +R3COOH;
+R3COOH;
③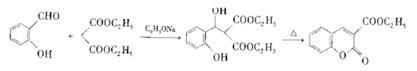
回答下列问题:
(1)A的名称是__________。
(2)B中含有的官能团是_________、B生成C的反应类型是__________。
(3)D生成E的反应类型是_______,D的结构简式为_______________。
(4)C生成聚—β—羟丁酸酯的化学方程式为________________。
(5)满足下列条件的试剂X的同分异构体共有_____种(不含立体异构)。
①与FeCl3溶液发生显色反应;
②能与NaHCO3反应放出CO2。
其中核磁共振氢谱显示为5组峰,且峰面积比为1:1:2:2:2的是____(写结构简式)。
(6)参照上述合成路线,以间二甲苯(![]() )为原料(无机试剂任选),设计环酯
)为原料(无机试剂任选),设计环酯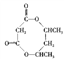 的合成路线:_________________。
的合成路线:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
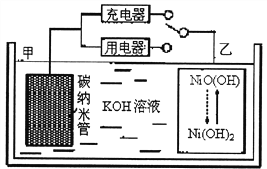
A. 电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
B. 放电时,甲电极为负极,OH-移向乙电极
C. 放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D. 充电时,电池的碳电极与直流电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是
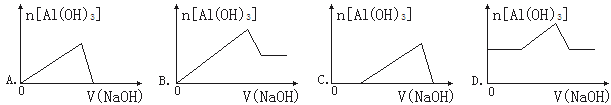
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com