
下列溶液中微粒浓度关系一定正确的是
A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1??
B.醋酸与醋酸钠的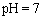 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+)
的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+)
C.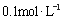 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-)
的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-)
CD
【解析】
试题分析:将pH=5的H2SO4溶液稀释1×103 属于无限稀释,溶液接近中性,此时水的电离不能忽略,所以c(H+):c(SO42-)=2:1不成立,A错误;醋酸与醋酸钠的混合溶液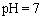 ,则c(H+)= c(OH-),所以必有 c(Na+)=c(CH3COO-),B错误;
,则c(H+)= c(OH-),所以必有 c(Na+)=c(CH3COO-),B错误;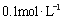 的硫酸铵溶液有电荷守恒式c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)+c(H+)>c(SO42-)+c(OH-)必成立,C正确; NaHC2O4溶液pH=4显酸性,说明HC2O4- 电离大于水解,所以水解产生的草酸浓度小于电离产生的草酸跟离子浓度,D正确;故选CD。
的硫酸铵溶液有电荷守恒式c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)+c(H+)>c(SO42-)+c(OH-)必成立,C正确; NaHC2O4溶液pH=4显酸性,说明HC2O4- 电离大于水解,所以水解产生的草酸浓度小于电离产生的草酸跟离子浓度,D正确;故选CD。
考点:本题考查的是酸的稀释、溶液总离子浓度大小比较等知识。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
下列有
关溶液中微粒的物质的量浓度关系正确的是
A.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c (NH4+)大小顺序为①=②>③
B.0.1mol/L Na2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:
c(CO32-)+2c(OH-)= c(HCO3-)+3c(H2CO3)+2c(H+)
C.在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+)
D.0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合:
c (Cl-)>c (Na+)>c(NH4+)>c (OH-)>c (H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com