
对少量的碘化物可利用“化学放大”反应进行测定。其步骤如下:在中性或酸性介质中先用Br2将试样中的I-定量地氧化成碘酸盐,然后加入过量的KI,用CCl4萃取生成的I2(萃取率为100%)。分区水层后,用肼(即联氨H2N—NH2)的水溶液将I2反萃取至水层中(H2NNH2+2I2=4I-+N2+4H+),在用过量的Br2氧化,除去剩余的Br2后加入过量的KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定(反应式为I2+2S2O32-=S4O62-+2I-),求得I-的含量。
(1)上述过程中有一些化学反应的方程式在题中未给出,请写出它们的离子方程式。
(2)根据有关反应的化学计量关系说明经上述步骤后试样中1molI-可消耗Na2S2O3的物质的量是多少?
(3)若在测定时,准确移取25.00mL含KI的试液,终点时耗用20.06mL0.100mol/L Na2S2O3溶液,请计算试液中KI的物质的量浓度。
(1)I-+3Br2+3H2O=IO3-+6Br-+6H+ ,IO3-+5I-+6H+=3I2+3H2O。
(2)1molI-可消耗36molNa2S2O3
(3)2.23×10-3mol·L-1
本题给出了有关定量分析方法的信息,涉及了一些未知的化学反应以及定量分析的步骤,解题时必须理清题中思路,把握住化学变化的脉络,找出相关物质之间的物质的量的关系,列出关系式即可。此题的信息源是定量分析中的测定微量I-的一种方法,剂“化学放大法”。由题中提供的思路可得如下关系:
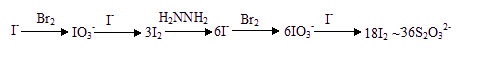 |
很显然,1molI-最终生成18molI2(含36molI),相当于放大36倍,耗36mol S2O32-。
根据上述分析即可求解第(3)问,设KI物质的量浓度为x,则有:
I- ~ 36S2O32-
1mol 36mol
0.025x 0.100×0.02006mol
求得x=2.23×10-3mol/L。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com