
【题目】根据如图所示装置回答以下问题。

(1)利用如图装置可以验证元素非金属性的变化规律。图中D装置的名称是__,其作用是___。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2、Na2SO3、Na2CO3、H2O2、H2SO4,请选择合适药品设计实验验证氯的非金属性强于硫:装置B中发生反应的化学方程式为:__,装置C中发生的离子方程式为:__。
(3)若要用此装置证明非金属性:S>C>Si,从以下所给物质中选择药品设计实验:①稀盐酸②稀H2SO4③CaCO3④Na2CO3⑤Na2SiO3溶液⑥SiO2。试剂B与C分别为___(填序号);装置C中发生反应的离子方程式为:___。
【答案】(球形)干燥管 防倒吸 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O Cl2+S2-=S↓+2Cl- ④、⑤ CO2+H2O+![]() =H2SiO3↓+
=H2SiO3↓+![]()
【解析】
利用此装置证明元素的非金属性强弱,需比较最高价氧化物的水化物的酸性强弱,或通过单质与非金属阴离子的置换反应来证明。左边装置中,没有加热装置,若用于制氯气,需选择不需加热就能发生反应的药品;若用于制二氧化碳,则在选择硫酸的前提下,另一药品必须易溶于水,否则与硫酸的反应不能持续进行。
(1)图中D装置是一个下端接一段玻璃管的干燥管,其名称是(球形)干燥管,因为有些气体会溶于水产生倒吸,所以其作用是防倒吸。答案为:(球形)干燥管;防倒吸;
(2)验证氯的非金属性强于硫,应利用Cl2与Na2S发生置换反应,装置B中药品应选择KMnO4、浓盐酸,发生反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,装置C中发生的化学反应方程式为Cl2+Na2S=S↓+2NaCl,离子方程式为:Cl2+S2-=S↓+2Cl-。答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+S2-=S↓+2Cl-;
(3)若要用此装置证明非金属性:S>C>Si,则需发生两组反应,一组是H2SO4与Na2CO3反应,另一组是CO2通入Na2SiO3溶液中,所以试剂B与C分别为④、⑤;装置C中发生反应的离子方程式为:CO2+H2O+![]() =H2SiO3↓+
=H2SiO3↓+![]() 。答案为:④、⑤;CO2+H2O+
。答案为:④、⑤;CO2+H2O+![]() =H2SiO3↓+
=H2SiO3↓+![]() 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g)2Y(g)+nZ(g)。2min末已生成0.2molY,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率为__。
(2)2min末时X的浓度为___。
(3)化学反应方程式中n=__。
(4)2min末,W的转化率__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2,下列说法不正确的是
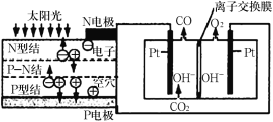
A.由图分析N电极为负极
B.OH-通过离子交换膜迁向右室
C.反应完毕,该装置中电解质溶液的碱性增强
D.阴极的电极反应式为CO2+H2O+2e-=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物,完成填空。
①CH4 ② C2H4 ③C2H2 ④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)①~⑧中,属于苯的同系物的是____ (填序号,下同)
(2)①分子的空间构型为_____,②中碳原子的杂化方式为_____。
(3)相同质量的①②③中,在相同状况下体积最小的是___,完全燃烧时消耗O2最多的是___。
(4)以⑧为原料制备TNT的化学方程式为______。
(5)④的系统命名为:____。
(6)若将CH4、O2和氢氧化钠溶液组成燃料电池,则电池的负极反应式为___。
(7)写出⑤的含有苯环的所有同分异构体______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,极易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式为_________。
(2)某小组通过NaClO3法制备ClO2,其实验装置如下图。
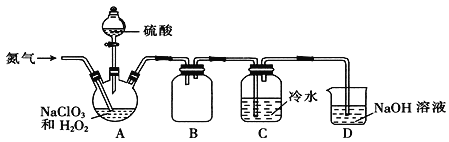
①通入氮气的主要作用有两个,一是可以起到搅拌作用,二是______________;
②装置B的作用是______________;
③装置A用于生成ClO2气体,该反应的化学方程式为______________;
④当看到装置C中导管液面上升时应进行的操作是______________。
(3)测定装置C中ClO2溶液的浓度:用______________(填仪器名称)取10.00 mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,用0.1000 mol·L-1的Na2S2O3标准液滴定至溶液呈淡黄色,发生反应:I2+2S2O32-=2I-+S4O62-,再加入__________作指示剂,继续滴定,当溶液_______,即为终点。平行滴定3次,标准液的平均用量为20.00 mL,则C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D是淡黄色固体化合物,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是
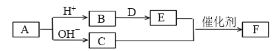
A.简单离子半径大小关系:c>d>e
B.简单阴离子的还原性:a>c>d
C.氢化物的沸点:c>d
D.C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO2,可以减少温室气体排放,还可以获得燃料或重要的化工产品。回答下列问题:
(1)CO2的捕集
①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。写出“捕集”CO2反应的离子方式_____________。
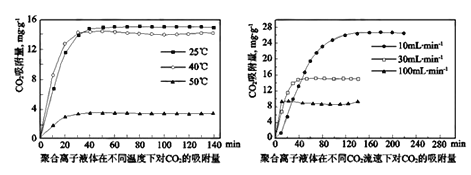
②聚合离子液体是目前广泛研究的CO2吸附剂。结合图像分析聚合离子液体吸附CO2的有利条件是_________________________。
(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s)CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
①写出上述合成尿素的热化学方程式___________________________。该反应化学平衡常数K的表达式:_________________________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:
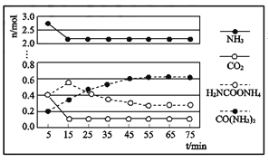
已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到___________min时到达平衡
(3)合成乙酸:中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
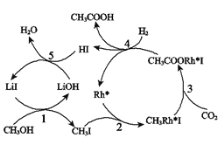
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式_______________________。
②根据图示,写出总反应的化学方程___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成_________
(2)甲苯制备TNT_______,用系统命名给TNT命名________
(3)写出2-丙醇的消去反应化学方程式_________
Ⅱ.(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有一个碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是:_____(任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名:_________。
②A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com