
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计右图所示的实验装置,
图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开了漏斗的活塞,将稀硫酸滴入气球中。请填空:
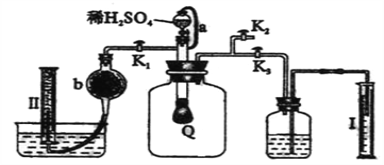
(1)Q内发生化学反应时,生成的气体是__________________。(写化学式)
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是______________,应当打开的是_______________。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________________。
(4)b中装的固体试剂是_____________,缓缓打开K1的原因是______________________。
(5)实验结束时,量筒I中有x mL水,量筒II中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是__________________________________(需化成最简表达式。)
【答案】 O2、CO2 K1、K2 K3 气球逐渐变小,量筒Ⅱ中有气体进入,水被排出 碱石灰 控制气流量,使CO2能被碱石灰充分吸收 78y/(53x+25y)
【解析】试题分析:本题考查Na2O2样品纯度的测定。Na2O2变质的原因是Na2O2与CO2发生反应生成Na2CO3和O2,部分变质的Na2O2样品中含Na2O2和Na2CO3。
(1)将稀硫酸滴入Q中,Q中发生的反应为:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,生成的气体为O2、CO2。
(2)Q中发生反应产生气体,所以可观察到气球逐渐变大。通过对两种量气装置的对比,为了测定反应生成气体的总体积,滴加稀硫酸之前,应当关闭的是K1、K2,应当打开的是K3,这样反应产生的气体将广口瓶中气体排进集气瓶中,通过测量量筒I中液体的体积来确定反应生成的气体的总体积。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓慢打开K1,广口瓶内外相通,气球Q逐渐变小,气球中的气体被排入左侧量气装置中,则量筒II中有气体进入,水被排出。可观察到的现象:气球逐渐变小,量筒Ⅱ中有气体进入,水被排出。
(4)由于CO2溶于水,O2难溶于水,所以量筒II中量取的是O2的体积,b中装的试剂的作用是吸收CO2,b中的固体试剂为碱石灰。缓缓打开K1的原因是:控制气流量,使CO2能被碱石灰充分吸收。
(5)根据上述分析,量筒I中量取的是CO2和O2的总体积,量筒II中量取的是O2的体积,O2的体积为ymL,CO2的体积为(x-y)mL,根据反应2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑得出n(Na2O2)=2n(O2)=2y/22400mol,m(Na2O2)=156y/22400g;根据反应Na2CO3+H2SO4=Na2SO4+H2O+CO2↑得出n(Na2CO3)=n(CO2)=(x-y)/22400mol,m(Na2CO3)=106(x-y)/22400g;则Na2O2的纯度为156y/22400g![]() [156y/22400g+106(x-y)/22400g]=78y/(53x+25y)。
[156y/22400g+106(x-y)/22400g]=78y/(53x+25y)。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)2Z(g)+M(s),5min后达到平衡,此时生成0.2mol Z.下列说法正确的是( )
A.若将容器压缩时,正逆反应速率均不变
B.5 min内平均反应速率v(X)=0.02 mol/(Lmin)
C.向平衡后的体系中加入l molM(s),平衡向逆反应方向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数值,下列说法正确的是( )
A. 18g水所含电子数为NA B. 14gCO和N2的混合气体所含分子数为NA
C. 16gO2和O3的混合气体所含质子数为8NA D. 58.5gNaCl所含的离子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)用标准溶液润洗滴定管2﹣3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2﹣3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)排去碱式滴定管中气泡的方法应采用如图的操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)E操作中在锥形瓶下垫一张白纸的作用是
(3)实验中,用左手控制(填仪器及名称),眼睛应注视 , 直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该盐酸溶液的准确浓度为 . (保留小数点后4位)
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是: (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下: 
下列有关叙述正确的是( )
A.I的分子式为C9H10O4
B.II中所有原子有可能均共面
C.可用FeCl3溶液鉴别有机物I和III
D.1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用无水芒硝(Na2SO4)﹣炭粉还原法,其流程示意图如图1: 
(1)上述流程中“碱浸”后,物质A必须经过(填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2 , 写出煅烧时发生的总的化学反应方程式为 .
(2)上述流程中采用稀碱液比用热水更好,理由是 .
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,则此时溶液中c( S2﹣)= . (已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10﹣36、2.2×10﹣20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图2所示).为使除汞效果最佳,应控制的条件是、 . ②某毛纺厂废水中含0.001 molL﹣1的硫化钠,与纸张漂白后的废水(含0.002 molL﹣1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将地壳中含量较多的四种元素按从多到少的顺序排列,正确的是
A.Si、O、Al、FeB.O、Si、Al、FeC.Al、Fe、O、SiD.Si、Al、O、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙酸和乙醇发生酯化反应的说法正确的是
A. 用CH3CH218OH与CH3COOH发生酯化反应,生成H218O
B. 浓硫酸的作用是中和碱性物质
C. 反应液混合时,顺序为先取乙醇再加入浓硫酸最后加入乙酸
D. 用蒸馏的方法从饱和Na2CO3溶液中分离出乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com