
【题目】同时对农作物施用含N、P、K的三种化肥,给定下列化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤NH3·H2O。其中最合理的组合方式是( )
A. ①③④ B. ②③④ C. ①③⑤ D. ②③⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Fe是日常生活中最常用的金属之一。回答下列问题:
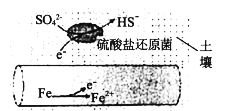
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被SO42-腐蚀,其电化学腐蚀原理如下图所示,写出正极的电极反应式___________________。
(2)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H=-354.2kJ/mol;3Fe(s)+2O2(g)=Fe3O4(s) H=-550.9kJ/mol则反应:2Fe3O4(s)+1/2O2(g) ===3Fe2O3(s)的H为_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(3)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2+ +I2(在水溶液中)。
2Fe2+ +I2(在水溶液中)。
①298K时,向5mL 0.1molL1 的KI溶液中滴加0.1molL1 FeCl3溶液,得到c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:
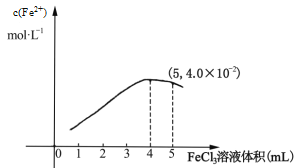
该温度下滴加5mL FeCl3溶液时,Fe3+的平衡转化率=_____%,平衡常数K=_____,若要提高Fe3+的转化率,可采取的措施是________________________。
②在已经达到平衡的上述反应体系中,加入苯对I2进行萃取,保持温度不变,反应速率_____ (填“增大”、“减小”或“不变”),此时υ(正)_____υ(逆)(填“大于”、“小于”或“等于”)。
③υ(正)与Fe3+、I的浓度关系为υ=kc(I-)mc(Fe3+)n(k为常数)
c(I)molL1 | c(Fe3+)molL1 | υ (molL1s1 ) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
通过分析所给数据计算可知:在υ=kc(I-)mc(Fe3+)n 中,m,n的值为_____(填字母代号)。
A.m=1,n=1 B.m=2,n=1 C.m=2,n=2 D.m=1,n=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如上图所示,下列说法正确的是________。
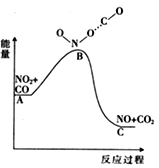
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
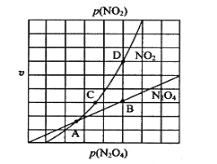
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
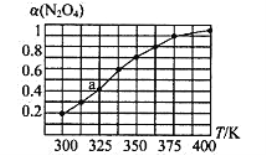
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系υ( N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
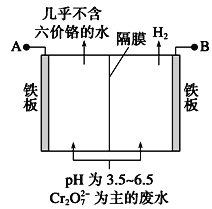
(3)采用电解法处理含铬废水原理如下图所示。阳极的电极反应式为___________,阳极区溶液中发生反应: ________________________,阴极产生的气体为_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求表达下列变化过程中的化学用语,写化学方程式,其中(4)(5)写出反应的离子方程式。
⑴金属镁在CO2中燃烧_______________________
⑵加热碳酸氢钠固体___________________
⑶过氧化钠与水的反应________________
⑷KCl溶液与AgNO3溶液反应____________
⑸钠与硫酸铜溶液反应__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除了金、铂等极少数金属外,绝大多数金属元素以化合物的形式存在于自然界。利用金属活泼性的不同,可以采用不同的冶炼方法获取金属。
(1)“ 霍尔一埃鲁铝电解法” 是以氧化铝为原料、冰晶石为熔剂通过电解的方法制得铝,该反应的化学方程式是____________。
(2)获得金属锰一般用“ 铝热法”,即在高温下用铝与二氧化锰反应,该反应的化学方程式是________,其中的还原剂是______________。
(3)“ 皮江法” 冶炼镁的工业流程如下所示:
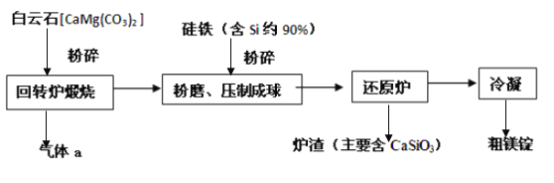
①气体a是_____________;
②粉碎、粉磨的目的是______________和________________;
③还原炉中将空气抽出,使炉内近似真空的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
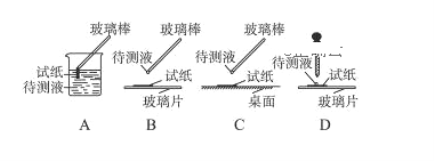
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。
(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com