
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
?? C+?? K2Cr2O7+ ?????? —?? ?? CO2↑+ ?? K2SO4 + ?? Cr2(SO4)3+?? H2O
①完成并配平上述化学方程式。
②在上述方程式上用单线桥标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是?????????????????? 。
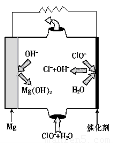
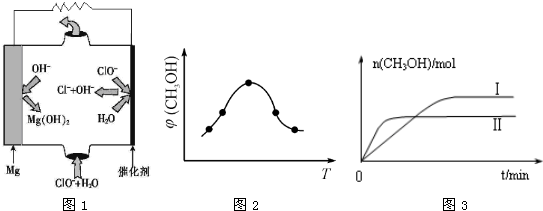
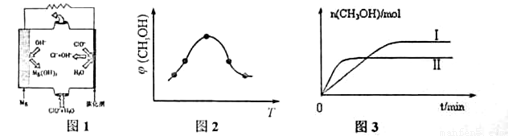
②由MgO可制成“镁-次氯酸盐”电池,其装置示意图如图1,该电池反应的离子方程式为 ????????? 。
 ????
????  ??
??  ?
?
图1????????????????? 图2????????????????? 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) CH3OH(g) +H2O(g)? △H
CH3OH(g) +H2O(g)? △H
①该反应的平衡常数表达式为K=???? ????? ????? 。
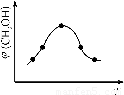
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的△H?????? 0(填“>”“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为KⅠ????? KII(填“>” “<”或“=”)。
(1)①3? 2? 8? H2SO4? 3? 2? 2? 8 (2分)
②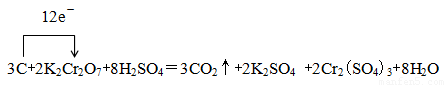 (1分)
(1分)
(2)①2MgSO4 + CO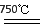 2MgO + SO2 + CO2 + SO3(3分)
2MgO + SO2 + CO2 + SO3(3分)
②Mg + ClO- + H2O=Cl- + Mg(OH)2(3分)
(3)①K=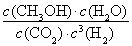 (2分)??? ②< (2分)?? ③> (2分)
(2分)??? ②< (2分)?? ③> (2分)
【解析】
试题分析:(1)①根据反应式可知,反应中碳元素的化合价从0价升高到+4价,失去4个电子,碳是还原剂。Cr元素的化合价从+6价降低到+3价,得到3个电子,K2Cr2O7是氧化剂。根据电子得失守恒可知,还原剂碳与氧化剂K2Cr2O7的物质的量之比是3:2。根据原子守恒可知,反应前还有硫酸参加,因此配平后的方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4 +2Cr2(SO4)3+8H2O。
②根据①可知,用单线桥标出该反应电子转移的方向与数目为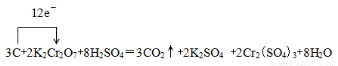 。
。
(2)①用CO还原MgSO4,在750℃时,测得气体中含等物质的量SO2和SO3,其中S元素的化合价从+6价降低到+4价,得到2个电子,所以根据电子得失守恒可知,CO的氧化产物是CO2,且与SO2的物质的量相等,因此此时反应的化学方程式是2MgSO4 + CO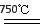 2MgO + SO2 + CO2 + SO3。
2MgO + SO2 + CO2 + SO3。
②根据图1可知,镁是负极失去电子转化为氢氧化镁。次氯酸盐在正极得到电子,被还原为氯离子,所以该电池的总反应离子方程式为Mg + ClO- + H2O=Cl- + Mg(OH)2。
(3)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知该反应的平衡常数表达式为K=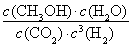 。
。
②根据图2可知,在甲醇的含量达到最大值后,如果升高温度,甲醇的含量反而降低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
③根据图3可知,曲线Ⅱ首先达到平衡状态,这说明曲线Ⅱ的反应速率快。但曲线Ⅱ对应的甲醇物质的量小于曲线I对应的甲醇的物质的量。由于该反应是体积减小的放热的可逆反应,所以反应条件应该是升高温度,促使平衡向逆反应方向移动,因此平衡常数减小,即KⅠ>KII。
考点:考查氧化还原反应配平、表示;原电池判断;平衡常数以及外界条件对平衡状态的影响


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省青岛市高三自评(二模)化学试卷(解析版) 题型:计算题
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 _____;
②由MgO可制成“镁——次氯酸盐”电池,其装置示意图如图1,该电池正极的电极反应式为_________;

(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)
△H=QkJ/mol
CH3OH(g)
△H=QkJ/mol
①该反应的平衡常数表达式为K=_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中发生上述反应,反应相同时间后测得甲醇的体积分数 ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
③在其中两个容器中,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为K1_________K11(填“>”“<”或“=”)。
(3)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ/mol
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暧,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C+___K2Cr2O7+___—___CO2↑+ ___K2SO4+ ___Cr2(SO4)3+___H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式________
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为_____________________。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)(g)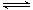 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K_______。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数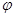 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0
(填 “>”、“<”或“
=” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0
(填 “>”、“<”或“
=” )。
③在同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线 I、II对应的平衡常数大小关系为KI_______KII (填“>”、“<”或“ = ”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com