
【题目】有关晶体的下列说法中,正确的是( )
A.分子晶体中分子间作用力越大,分子越稳定
B.二氧化硅的熔点、硬度均比二氧化碳高
C.冰融化时水分子时,仅共价键发生断裂,分子本身没有变化
D.氯化钠熔化时离子键被破坏,故属于化学变化
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列除杂质的操作中不正确的是
A. 铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B. FeCl2溶液中混有FeCl3加入过量铁粉充分反应后过滤
C. Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液
D. AI(OH)3中混有Mg(OH)2:加入足量烧碱溶液后过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出对应的元素符号:C________,D_______
(2)用电子式表示A与E两元素形成化合物的过程:___________________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化曲线如图所示,判断下列叙述中正确的是

A.每生成2 mol AB时吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键时放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(B类题)将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+![]() O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的燃烧热为____________;写出其热化学方程式 。
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为 。
(3)炼制1 t(吨)含铁96%的生铁所需焦炭的理论用量是________t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在一个2L的密闭容器中,发生反应2SO3(g)![]() 2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
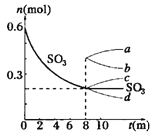
(1)用O2表示0~8min内该反应的平均速率v=__________.
(2)升高温度, K值将__________;容器中气体的平均相对分子质量将__________.(填“增大”“减小”或“不变”)
(3)能说明该反应已达到平衡状态的是__________
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)从8min起,压缩容器为1L,则SO3的变化曲线为__________
A. a B. b C. c D. d.
II、将气体A、B置于容积为2L的密闭容器,发生如下反应:4A(g)+B(g)=2C(g)起始时充入0.5molB和一定量的A,反应进行到4s末,测得v(B)=0.0125mol·L-1·s-1,A、C均为0.2mol。则
(1)V(A) =____________
(2)反应前A有_________mol
(3)B的转化率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,工业上将NO2在密闭容器中经多次氧化,用水反复循环吸收制备硝酸。
(1)假定上述过程无其他损失,试写出上述反应的化学方程式:______________________;
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置己略去)。

①检査装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入__________至U形管右侧胶塞下沿后,迅速关闭K1,U形管内反应的化学方程式是_________________。
②蘸NaOH溶液的棉花团的作用是____________;
③装置Ⅲ的作用为_________________________;
④打开K2,长玻璃管中液面上升,____________则证明NO也可以与氧气和水共同反应生成HNO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
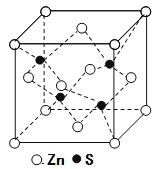
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com