
分析 (1)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(2)燃烧热是指1mol可燃物完全燃烧生成稳定化合物时放出的热量,根据1.00gC6H6(l)燃烧放出的热量计算;
(3)依据热化学方程式和盖斯定律计算得到.
解答 解:(1)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为:-57.3 kJ/mol;$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)1g C6H6(l)燃烧生成CO2(g)和H2O(l),放出40kJ的热量,则1molC6H6(l)燃烧放出的热量为:78g/mol×41.8KJ/g=3260.4KJ/mol,
故答案为:3260.4;
(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ•mol-1
依据盖斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol;
故答案为:+124.2.
点评 本题考查了反应热的计算、热化学方程式和盖斯定律计算应用,注意把握反应热的计算方法、热化学方程式的书写方法以及盖斯定律的含义,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: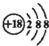 | |
| B. | NaClO的电子式: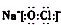 | |
| C. | 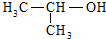 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$ I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
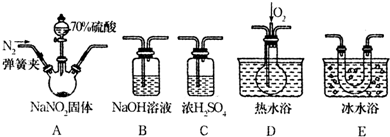
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
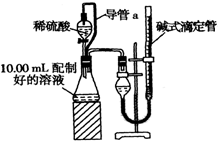 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com