
| n(X) | n(Y) |
| 2x |
| (4-2x+2-x+2x) |
| 2y |
| n(X)-2y+n(Y)+2y |
| 1 |
| 2 |
| n(X) |
| n(Y) |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 CH3OH��g����H
CH3OH��g����H| �¶� | 250��C | 300��C | 350��C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ �� ʱ �� �� �� |
CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2NO��g����H��0
2NO��g����H��0| c2(NO) |
| c(N2)?c(O2) |
| c2(NO) |
| c(N2)?c(O2) |
| (3��10-3 )2 |
| (2.5��10-1)��(4.0��10-2) |
| (3��10-3 )2 |
| (2.5��10-1)��(4.0��10-2) |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������ܿ��ص������У�߶���ѧ�ڵ�һ��������ѧ������������ ���ͣ������
(12��)���ŵ���������Ⱦ���������أ��ҹ����ڡ�ʮ���塱�ڼ�Ӵ�Ե��������ŷŵĿ������ȡ�Ŀǰ����������������Ⱦ�ж��ַ�����
��1���û���̿��ԭ��������������йط�ӦΪ��C��g��+2NO(g) N2(g)+CO2(g) ��H.ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO�����£�T1�棩�����·�Ӧ����Ӧ���е���ͬʱ�̲�ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H.ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO�����£�T1�棩�����·�Ӧ����Ӧ���е���ͬʱ�̲�ø����ʵ�Ũ�����£�
| Ũ��/mol?L-1 ʱ��/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������ܿ��ص������У�߶���ѧ�ڵ�һ��������ѧ���������棩 ���ͣ������
(12��)���ŵ���������Ⱦ���������أ��ҹ����ڡ�ʮ���塱�ڼ�Ӵ�Ե��������ŷŵĿ������ȡ�Ŀǰ����������������Ⱦ�ж��ַ�����
��1���û���̿��ԭ��������������йط�ӦΪ��C��g��+2NO(g) N2(g)+CO2(g)
��H.ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO�����£�T1�棩�����·�Ӧ����Ӧ���е���ͬʱ�̲�ø����ʵ�Ũ�����£�
N2(g)+CO2(g)
��H.ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO�����£�T1�棩�����·�Ӧ����Ӧ���е���ͬʱ�̲�ø����ʵ�Ũ�����£�
|
Ũ��/mol•L-1 ʱ��/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K= ��������λС����
��30min�ı�ijһ����������һ��ʱ���Ӧ���´ﵽƽ�⣬��ı������������
����30min�������¶���T2�棬�ﵽƽ��ʱ�������е�NO��N2��CO2��Ũ��֮��Ϊ5:3:3����÷�Ӧ�ġ�H �����������������=����0
��2����CH4����ԭ��������������������������Ⱦ����֪��
��CH4��g��+4NO2(g)=4NO(g)+CO2(g)+2H20(g) ��H=-574kJ.mol-1
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ.mol-1
��H2O(g)=H2O(l) ��H=-44.0kJ.mol-1
д��CH4��NO2��Ӧ����N2(g) ��CO2(g)�� H2O(l)���Ȼ�ѧ����ʽ��
��3��ѡ���Դ���ԭ��SCR������������ĿǰӦ����㡢����Ч��������������֮һ���ü����漰���·�Ӧ��4NO(g)+4NH3(g)+ O2(g)=��4N2(g)+ 6H2O(g),�ں��ݵ��ܱ������У������й�˵������ȷ���� ������ĸ��
A�������������䣬ʹ�ø�Ч������������NO��ת��������
B����λʱ��������NH3��NO�����ʵ���֮��Ϊ1:1ʱ����Ӧ�ﵽƽ��
C��������������ʱ�����¶ȣ���Ӧ��ƽ�ⳣ����С
D����Ӧ�ﵽƽ������������г�������ķ�Ӧ��ٴδﵽƽ��ʱ��NO��ת���ʼ�С
��4����NO2 ��O2������NaNO3��ɵ�ȼ�ϵ��װ����ͼ��ʾ����ʹ�ù�����ʯī��缫��Ӧ����һ��������Y���õ缫�ĵ缫��Ӧ�ɱ�ʾΪ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ����5��ģ����������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣����ŵ���������Ⱦ���������أ����ҽ��ڡ�ʮ���塱�ڼ�Ӵ�Ե��������ŷŵĿ������ȡ�Ŀǰ����������������Ⱦ�ж��ַ�����
(1)�û���̿��ԭ��������������йط�ӦΪ��C(s)��2NO(g) N2(g)��CO2 (g) ��H��ij�о�С����ij�����ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)��CO2 (g) ��H��ij�о�С����ij�����ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
|
Ũ��/mol��L��1 ʱ��/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
�����и������Ϊ�жϷ�Ӧ�ﵽ��ѧƽ��״̬���ݵ���
A.������CO2 ��Ũ�ȱ��ֲ��� B��v��(N2) ��2 v��(NO)
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
E����������ƽ����Է����������ֲ���
��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K�� ��������λС������
��30min�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������ ��
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5��3��3����÷�Ӧ�ġ�H 0����������� ������������
(2)��CH4����ԭ��������������������������Ⱦ����֪��
��CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H����574 kJ��mol��1
��CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H����1160 kJ��mol��1
��H2O(g)��H2O(l) ��H����44.0 kJ��mol��1
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(1)���Ȼ�ѧ����ʽ ��
(3)��NO2��O2������NaNO3��ɵ�ȼ�ϵ��װ����ͼ��ʾ����ʹ�ù�����ʯīI�缫��Ӧ����һ��������Y���йص缫��Ӧ�ɱ�ʾΪ ��
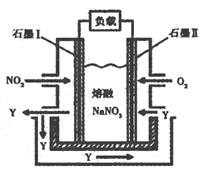
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com