
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | 铅蓄电池中Pb作负极,PbO2作正极 | |
| C. | 在物质的量浓度相等的NaCl和KBr的混合溶液中滴加AgNO3溶液,先产生淡黄色沉淀 | |
| D. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n |
分析 A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
B.铅蓄电池放电时易失电子的电极作负极、得电子的电极作正极;
C.溶解度小的物质先产生沉淀;
D.醋酸是弱电解质、HCl是强电解质,常温下pH=3的盐酸和醋酸,c(HCl)<c(CH3COOH),加水稀释促进醋酸电离,稀释相同倍数时醋酸中c(H+)大于盐酸,要使稀释后溶液的pH也相等,则醋酸应该加入水多写.
解答 解:A.电解精炼粗铜时,阳极上粗铜溶解、阴极上析出Cu,所以粗铜作阳极、纯铜作阴极,故A错误;
B.铅蓄电池放电时易失电子的电极作负极、得电子的电极作正极,所以Pb作负极、PbO2作正极,故B正确;
C.溶解度小的物质先产生沉淀,溶解度AgCl>AgBr,所以在物质的量浓度相等的NaCl和KBr的混合溶液中滴加AgNO3溶液,先产生淡黄色沉淀,故C正确;
D.醋酸是弱电解质、HCl是强电解质,常温下pH=3的盐酸和醋酸,c(HCl)<c(CH3COOH),加水稀释促进醋酸电离,稀释相同倍数时醋酸中c(H+)大于盐酸,要使稀释后溶液的pH也相等,则醋酸应该加入水多写,盐酸中加入水少些,即m<n,故D正确;
故选A.
点评 本题考查原电池和电解池、弱电解质电离等知识点,明确原电池和电解池原理、弱电解质电离特点是解本题关键,易错选项是D,采用逆向思维方法分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 主要是用来吸收或滴加少量试剂,以及吸取上层清液,分离沉淀 | |
| B. | 进行滴加的时候,胶头滴管要保持垂直在容器正上方 | |
| C. | 取液体时,先将胶头滴管伸入试剂瓶中,用手指捏紧滴管的胶头再放开手指 | |
| D. | 专用的胶头滴管在使用完之后,就一定要放回原试剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )
肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )| A. | 11.2L N2中含电子总数为7×6.02×1023 | |
| B. | 3.2g N2H4中含有共价键的总数为6×6.02×1022 | |
| C. | 标准状况下,22.4L H2O2中所含原子总数为4×6.02×1023 | |
| D. | 若生成3.6g H2O,则上述反应转移电子的数目为2×6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质既能溶于盐酸,又能溶于NaOH溶液,则该物质一定是Al2O3 | |
| B. | 某气体只含C、H两种元素,且质量之比为6:1,则该气体一定为纯净物 | |
| C. | SO2通入品红溶液中,溶液褪色,则SO2通入紫色石蕊试液中,溶液也褪色 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=2.0mol/(L•s) | B. | V(B)=1.2mol/(L•s) | C. | V(C)=3.2mol/(L•s) | D. | V(D)=4.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8KJ/mol | |
| B. | C2H4(g)+O2(g)═2CO2(g)+2H2O(l)△H=-1411.0KJ/mol | |
| C. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-6071.3KJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ/mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:填空题
同温同压下,相同体积的氢气和气体A的质量分别是0.2g和3.4g,则气体A的摩尔质量为 。A的分子数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
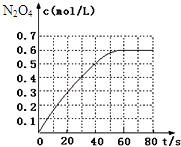 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com