
与主族元素在元素周期表中所处的位置有关的是
A.相对原子质量 B.核内中子数
C.次外层电子数 D.电子层数和最外层电子数
科目:高中化学 来源: 题型:
已知X、Y、Z 3种主族元素在元素周期表中的相对位置如右图所示,设X的原子序数为a,则下列说法中不正确的是( )
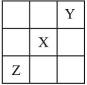
A.Y与Z的原子序数之和可能为2a B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31 D.X、Y、Z一定都是短周期元素
查看答案和解析>>
科目:高中化学 来源:2011届辽宁省铁岭中学高三第四次模拟考试(理综)化学部分 题型:填空题
(14分)X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表:
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是次外层的2倍 |
| Y | Y的气态氢化物的水溶液显弱碱性 |
| Z | Z是地壳中含量最多的金属元素 |
| W | 常温常压下,W的单质是淡黄色固体 |
| Q | …… |
 (1)元素Q在元素周期表中的位置______________________________.
(1)元素Q在元素周期表中的位置______________________________.
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省福州八县(市)一中高二下学期期中联考化学试卷 题型:填空题
(22分)已知X、Y、Z三种短周期主族元素在元素周期表中的位置关系如图所示。
| Z | |
| Y | X |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三下学期第六次模拟考试(理综)化学部分 题型:填空题
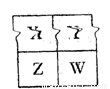
(1)已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,
W的气态氢化物的稳定性比Y (填“强”、“弱”或“不一定”),W的原子序数 (填“可能”或“不可能”)是Y的原子序数的2倍。
(2)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层
电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下(部分产物已略去):
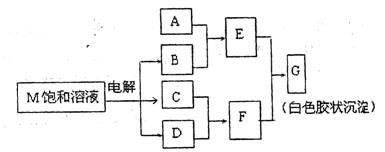
①若A是与X、Y同周期的一种常见金属,则A元素原子结构示意图为 ,
写出A与B溶液反应的离子方程式 。
②若A是某元素的一种常见酸性氧化物,则该元素的周期表中的位置是 ,
写出E与F反应的化学方程式 。
③电解M饱和溶液的产物之一B中的化学键为 。工业上用电解物质M的另一产物氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等。写出此反应的离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(本题10分) A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体。请回答下列问题:
(1)由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式__________________________。反应物的电子式 其所含化学键为 (a.离子键 b.极性共价键 c.非极性共价键)
(2)B元素比D元素的非金属性强的依据是: 。
①两元素组成的化合物中D元素为正价 ②单质的熔沸点的高低
③最高价氧化物对应的水化物的酸性强弱 ④气态氢化物的稳定性
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种粒子,它们均为负一价双原子核的阴离子,且甲含有18个电子,乙含有10个电子,则甲与乙反应的离子方程式_________________________________________________________。
(4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里相互反应的热化学方程式(已知此反应生成1molH2O时放出的热量为57.3KJ)_____________________________________________________________________
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则M极是该电池的________极;N极的电极反应式为:________________________。
由此给我们的启示:在能量电池的设计上,对化学反应的要求是:
①
② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com