
【题目】短周期元素T、R、W、G在周期表中的相对位置如图所示。下列说法正确的是
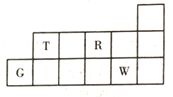
A.T的氢化物的沸点一定低于R的
B.W的氧化物对应的水化物一定是强酸
C.T和W组成的化合物含两种化学键
D.工业上电解熔融氧化物制备G的单质
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】硼元素的单质和化合物很多,我们可以利用所学知识认识和理解它们。
(1)硼元素位于元素周期表的__________区;硼元素的价电子排布式为_________。
(2)B、C、Si与H、O原子形成的单键和B、C、Si原子自成单键的键能如下表所示:
化学键 |
|
|
|
|
|
|
|
|
|
键能 | 389 | 411 | 318 | 561 | 358 | 452 | 293 | 346 | 222 |
①自然界中硼主要以含氧化合物的形式存在的原因是_____________。
②类似于烷烃,B、Si也有一系列氢化物,但从物质数量角度看:硅烷<硼烷<烷烃。原因是_________。
③推测晶体B的晶体类型是__________。
(3)乙硼烷![]() 具有强还原性,它和氢化锂反应生成硼氢化锂
具有强还原性,它和氢化锂反应生成硼氢化锂![]() ,硼氢化锂常用于有机合成。
,硼氢化锂常用于有机合成。![]() 由
由![]() 和
和![]() 构成。
构成。![]() 中B原子的杂化轨道类型为_______;
中B原子的杂化轨道类型为_______;![]() 中三种元素电负性由大到小的顺序是__________(写元素符号)。
中三种元素电负性由大到小的顺序是__________(写元素符号)。
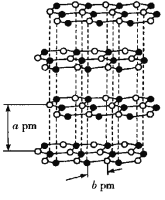
(4)氮化硼(BN)是一种重要的功能陶瓷材料。可通过下列反应得到:![]()
①□内物质的空间构型为__________。
②在与石墨结构相似的六方氮化硼晶体中,晶体的层间距为a pm,![]() 键键长为b pm,则六方氮化硼晶体的密度为__________
键键长为b pm,则六方氮化硼晶体的密度为__________![]() (用
(用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中的实验操作、仪器、试剂(部分夹持装置已略)均正确的是
A.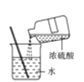 如图为稀释浓硫酸
如图为稀释浓硫酸
B. 如图可用于验证浓硫酸的脱水性和氧化性
如图可用于验证浓硫酸的脱水性和氧化性
C.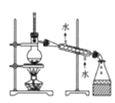 如图可用于分离乙酸与CH2Cl2
如图可用于分离乙酸与CH2Cl2
D.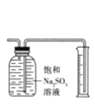 如图可用于测量SO2的体积
如图可用于测量SO2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
A. 等质量的NaHCO3和Na2CO3与足量的盐酸反应,产生CO2的质量:Na2CO3多
B. 等质量的NaHCO3和Na2CO3与盐酸反应,产生CO2的速率:NaHCO3快
C. CaCl2溶液加入到NaHCO3溶液中不产生沉淀,加入到Na2CO3溶液中产生白色沉淀
D. 除去Na2CO3固体中混有的少量NaHCO3的最好方法是加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂质(括号中为杂质)的操作中,错误的是( )
A.乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物
B.![]() (乙醇):多次加水,振荡,分液,弃水层
(乙醇):多次加水,振荡,分液,弃水层
C.![]() (
(![]() ):通入足量的高锰酸钾溶液
):通入足量的高锰酸钾溶液
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液A中可能含有如下离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。某同学设计并完成了如下的实验:
。某同学设计并完成了如下的实验:
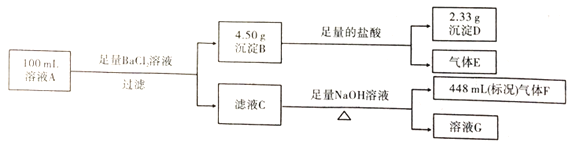
下列说法正确的是
A.气体F能使湿润的蓝色石蕊试纸变红
B.溶液A中一定存在![]() 、
、![]() 、
、![]() ,可 能存在
,可 能存在![]()
C.溶液A中一定存在![]() 、
、![]() 、
、![]() 、
、![]() ,可能存在
,可能存在![]()
D.溶液A中可能存在![]() ,且
,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Ⅰ是有机合成中间体,如可合成J或高聚物等,其合成J的线路图如图:
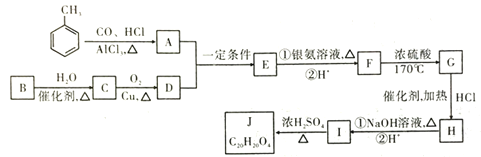
已知:①![]() ,A苯环上的一氯代物只有2种
,A苯环上的一氯代物只有2种
②有机物B是最简单的单烯烃,J为含有3个六元环的酯类
③![]()
![]() (
(![]() 、
、![]() 为烃基或H原子)
为烃基或H原子)
回答以下问题:
(1)A的化学名称为_____;E的化学式为_____。
(2)![]() 的反应类型:____;H分子中官能团的名称是____。
的反应类型:____;H分子中官能团的名称是____。
(3)J的结构简式为____。
(4)写出I在一定条件下生成高聚物的化学反应方程式____。
(5)有机物K是G的一种同系物,相对分子质量比G少14,则符合下列条件的K的同分异构体有___种(不考虑立体异构)。
a.苯环上只有两个取代基
b.既能发生银镜反应也能与![]() 溶液反应
溶液反应
写出其中核磁共振氢谱有6个峰,峰面积之比为2:2:1:1:1:1的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
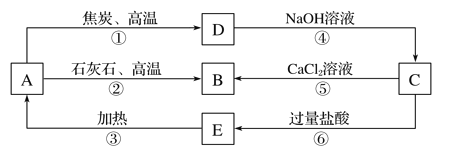
请回答:
(1)写出对应物质的化学式:A________________; C________________; E________________。
(2)反应①的化学方程式为_______________________________________。
(3)反应④的离子方程式为_____________________________________。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(![]() 、
、![]() 、
、![]() )与煤粉在催化剂条件下制乙炔,已知发生的部分反应如下:
)与煤粉在催化剂条件下制乙炔,已知发生的部分反应如下:
①![]()
②![]()
③![]()
请回答:
(1)依据上述反应,则![]()
![]() ____________
____________![]()
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。下图为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。

①乙炔体积分数在1530K之前随温度升高而增大的原因可能是______________________;1530K之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530K时测得气体的总物质的量为1.000mol,则反应![]() 的平衡常数K=__________________。
的平衡常数K=__________________。
③在恒温条件下,测得上述反应过程在相同时间时不同进料气n(氢气)/n(乙烯)下的乙炔产率﹐请画出乙炔产率随n(氢气)/n(乙烯)的变化关系图。
 ____________
____________
(二)乙炔―空气燃料电池是一种碱性(20%-30%的KOH溶液)的电池,电池放电时,负极的电极方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com