
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ·mol-1、ΔH=-285.8 kJ·mol-1、ΔH=-890.3 kJmol-1、ΔH=-2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )。
A.C(s)+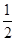 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.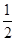 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 |
科目:高中化学 来源: 题型:单选题
下列有关热化学方程式书写及对应表述均正确的是
| A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol |
| B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol |
| C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol |
| D.已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关能量的判断或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)==C(金刚石) ΔH=+1.19 kJ·mol-1,可知:金刚石比石墨更稳定 |
| C.由H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,可知:含0.5 mol H2SO4的浓溶液与含1 molNaOH的溶液混合,放出热量大于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氢化热是指一定条件下,1 mol 不饱和化合物加氢时放出的热量。表中是环己烯( )、环己二烯(
)、环己二烯( )和苯的氢化热数据。
)和苯的氢化热数据。
| 化合物 | 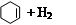  | 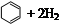  | 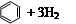  |
| 氢化热 (kJ/mol) | 119.7 | 232.7 | 208.4 |
 转变为
转变为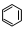 时放热
时放热查看答案和解析>>
科目:高中化学 来源: 题型:单选题
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g) 2H2O(l) ΔH="-285.8" kJ/mol 2H2O(l) ΔH="-285.8" kJ/mol |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol |
C.CH4(g)+2O2(g) CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是( )。
| A.氢气的燃烧热为241.8 kJ·mol-1 |
| B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1 |
| C.盐酸和氨水混合的热化学方程式:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.由③可知金刚石不及石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。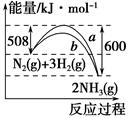
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,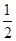 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=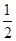 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
| A.上述热化学方程式中的化学计量数表示分子个数 |
| B.ΔH1>ΔH2 |
| C.ΔH2=-57.3 kJ·mol-1 |
| D.|ΔH1|>|ΔH2| |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选) ( )。
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选) ( )。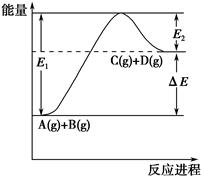
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com