(2009?北京)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO
2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
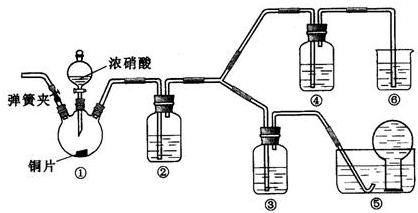
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO
2反应2NO
2+2NaOH=NaNO
3+NaNO
2+H
2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(3)装置①中发生反应的化学方程式是
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(4)装置②的作用是
将NO2转化为NO
将NO2转化为NO
,发生反应的化学方程式是
3NO2 +H2O=2HNO3 +NO
3NO2 +H2O=2HNO3 +NO
(5)该小组得出的结论依据的试验现象是
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别涉及了一下4个试验来判断两种看法是否正确.这些方案中可行的是
acd
acd
(填序号字母,多选不给分)
a)加热该绿色溶液,观察颜色变化
b)加水稀释绿色溶液,观察颜色变化
c)向该绿色溶液中通入氮气,观察颜色变化
d)向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化.



 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案