
【题目】巴豆酸的结构简式为CH3﹣CH═CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
A.只有②④⑤ B.只有①③④ C.只有①②③④ D.全部
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在; 钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)用离子方程式表示过程III和IV中Na2CO3的主要作用 。
(4)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2 吸水变色这一性质可制成变色水泥和显隐墨水.图2是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是 .

(5)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液。下列有关该溶液中微粒的物质的量浓度关系正确的是 (填序号)。
A.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A可能是下列物质中的( )

①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlC13溶液 ⑥单质铁
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐。为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
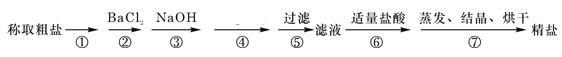
(1)第①步操作的名称是 ,第②步判断BaCl2已过量的方法是 。
(2)第④步加入试剂的化学式为 。
(3)第⑤步操作所需玻璃仪器的名称是 。
(4)若第⑤步、第⑥步顺序颠倒,将对实验结果产生影响,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. 溶液中OH-向电极a移动
B. O2在电极b上发生还原反应
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 电极a的反应式为2NH3-6e-+6OH-=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A. 无水硫酸铜、蔗糖 B. 生石灰、硫酸亚铁
C. 食盐、硫酸亚铁 D. 硅胶、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解饱和NaCl溶液的装置如下图所示:

请回答:
(1)电解饱和NaCl溶液的总反应方程式为______________。
(2)a端是直流电源的______________(填“负”或“正”)极。
(3)阳极上发生的反应式是__________________。
(4)结合电极反应式说明电解池右侧NaOH溶液浓度增大的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。

①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | a | b | c | d |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:

i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com