
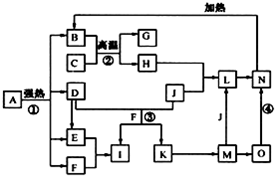
 仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答:
仔细阅读图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去).请按要求回答:分析 F是氧化物和氢化物,且F在常温下为液态,则F是H2O,C、H是日常生活中最常见的金属单质,应该为Al和Fe,结合转化关系中,B+C=G+H,可知是铝热反应,C为Al,H为Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M,M和J反应生成L,所以L为FeCl3,M为FeCL2,J为Cl2,判断K为HCl;D是形成酸雨的主要污染物判断为SO2,则I是H2SO4,E为SO3,以此解答该题.
解答 解:F是氧化物和氢化物,且F在常温下为液态,则F是H2O,C、H是日常生活中最常见的金属单质,应该为Al和Fe,结合转化关系中,B+C=G+H,可知是铝热反应,C为Al,H为Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M,M和J反应生成L,所以L为FeCl3,M为FeCL2,J为Cl2,判断K为HCl;D是形成酸雨的主要污染物判断为SO2,则I是H2SO4,E为SO3,
(1)应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4•7H2O,配平化学方程式得到2FeSO4•7H2O$\frac{\underline{\;强热\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O,
故答案为:2FeSO4•7H2O$\frac{\underline{\;强热\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O;
(2)反应②是铝热反应,反应易引发,反应放出大量热量,在工业生产上的一种用途是野外焊接钢轨,故答案为:野外焊接钢轨;
(3)反应③是二氧化硫和氯气在水溶液中的反应生成硫酸和盐酸,反应的离子方程式:Cl2+SO2+2H2O═4H++SO42-+2Cl-;反应④是氢氧化亚铁被氧化生成氢氧化铁的反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3 ,
故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;4Fe(OH)2+O2+2H2O═4Fe(OH)3 ;
(4)C是Al、H是Fe,I是H2SO4,常温下冷的浓硫酸与铁或铝能发生钝化现象而阻止进一步被氧化,所以可用铁或铝制容器储运浓硫酸,
故答案为:冷的浓硫酸与铁或铝制容器接触时,在表面生成一层致密的氧化膜,阻止金属继续与酸反应而使金属“钝化”,所以可用铁或铝制容器储运浓硫酸.
点评 本题以Fe、Al、S及其化合物为载体考查了无机物推断,为高考常见题型,侧重于学生的分析能力的考查,涉及铝热反应、离子方程式的书写、电解原理等知识点,综合性较强,根据物质的特殊现象、特殊性质等知识点来推断,题目难度中等.


科目:高中化学 来源: 题型:推断题
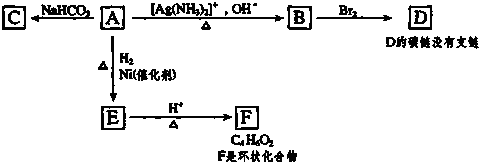
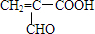 ;
;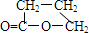 ,由E生成F的反应类型是酯化反应.
,由E生成F的反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 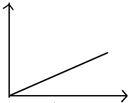 | B. | 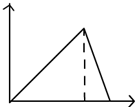 | C. | 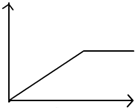 | D. | 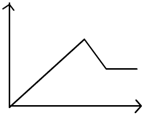 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
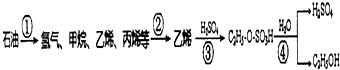 以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )| A. | 流程图①中产物均为烃类,产物均为可燃性气体 | |
| B. | 流程图①中需减压分馏,②中需分馏分离出乙烯 | |
| C. | 流程图③中发生加成反应,④中发生取代反应 | |
| D. | 乙醇、硫酸都能够使蛋白质变性,都可用于皮肤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇到石蕊试液变红的溶液:Na+、NH4+、K+、NO3- | |
| B. | 遇[Fe(CN)6]3-产生蓝色沉淀的溶液:Ca 2+、Cl-、ClO-、Fe3+ | |
| C. | 水电离出的c(OH-)=1×10-12 mol/L的溶液:S2O3-、Cl-、NO3-、Na+ | |
| D. | 与铝反应产生大量氢气的溶液:Ba 2+、HCO3-、I-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
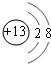 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 平衡常数K | 甲的物质的量 | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com