
【题目】硫代硫酸钠是一种重要的化工产品。工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。


烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩冷却,过滤,洗涤,干燥,即得到粗产品(主要含有Na2S2O35H2O和其他杂质)。某兴趣小组为测定该产品纯度,准确称取4.96 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。反应原理为:2S2O32-+I2=S4O62-+2I,滴定至终点时,滴定起始和终点的液面位置如下图,则产品的纯度为_____。经仪器分析,该产品纯度为16%,分析该兴趣小组测定产品纯度偏差的原因(忽略人为误差) 。[M(Na2S2O35H2O)=248g/mol]
【答案】(1)液柱高度保持不变 防止倒吸 NaOH(合理即得分)
(2)2:1 c 控制滴加硫酸的速度(合理即得分)
溶液变澄清(或浑浊消失) (6)18.1%
粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大
【解析】
试题分析:(1)检验装置的气密性,用气体的压强的变化来检验,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若一段时间内,液柱高度保持不变,证明装置的气密性良好;D为安全瓶,可防止发生倒吸;二氧化硫或硫化氢溶于水呈酸性,所以用氢氧化钠溶液吸收,则装置E中盛放的是NaOH溶液;
(2)根据题目所给3个反应方程式,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,所以还需要1Na2SO3,因此烧瓶C中Na2S和Na2SO3物质的量之比为2:1;
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小,所以选择饱和亚硫酸氢钠溶液,答案选c;
(4)SO2通过70% H2SO4与Na2SO3反应制取,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度;
(5)反应III是固体S与亚硫酸钠的反应,所以烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失);
(6)根据图中示数,起始读数为0.00mL,终点时读数是18.10mL,则消耗标准碘溶液的体积为18.10mL,则Na2S2O35H2O的质量是0.0181L×0.1000mol/L×2×248g/mol=0.89776g,则Na2S2O35H2O的纯度是0.89776g/4.96g×100%=18.1%。粗产品中含有Na2SO3(或Na2S)可以消耗I2,使消耗的碘水体积偏大,使测定结果偏高。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】同位素示踪技术已广泛应用在农业、工业、医学地质及考古等领城。下列有关叙述正确的是
A.D2O和H2O互为同位素B.14C与12C是两种不同的核素
C.35Cl2与37Cl2互为同素异形体D.通过化学变化可以实现18O与16O之间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W是由A、B两种元素组成的AB2型化合物。
(1) 若W是最常见的温室气体则其结构式为 ;
(2)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。该反应的化学方程式为 。
(3)若W是离子化合物,其阴、阳离子均含18个电子,
①当阴、阳离子个数比为2∶1时W的电子式为 ;
②当阴、阳离子个数比为1∶1时阴离子的电子式为 。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。①如A、B为相邻周期时B在元素周期表中的位置为 。W的水溶液被双氧水氧化的化学方程式为 。
②如果A元素的周期序数是B元素的两倍,A的最高价氧化物对应水化物的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:

请回答以下问题:
(1)合成氨反应的化学方程式是 ,该反应在 (填设备名)中发生。沉淀池中发生的主要反应方程式是 ,该反应能够发生的原因是 。
(2)在上述流程的沉淀池中通入足量氨气的目的是 ,可以循环使用的X是 。
(3)该生产过程中的副产品是 。从绿色化学和资源综合利用的角度说明上述流程的主要优点是 ;从物质的性质和工业生产实际的角度考虑该流程的主要缺陷是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )

A.NaOH溶液可用于除去实验中多余的SO2
B.蓝色石蕊试纸先变红后褪色
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性强于I2
D.品红试纸、蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体.A、B. C. D. E.F和OPA的转化关系如下所示:
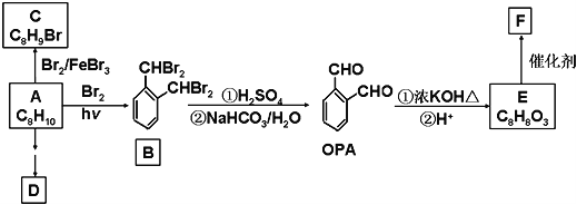
已知:
回答下列问题:
(1)A的化学名称是___;
(2)写出C所有可能的结构简式___;
(3)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A. 不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D的路线___;
(4)OPA的化学名称是___,OPA经中间体E可合成一种聚酯类高分子化合物F,该反应的化学方程式为_______;
(5)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G任意一种可能的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的框架图,请根据下面提问回答:

(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
(2)用物质的名称填写,硬度最大的是单质是 ,密度最小的金属是 ;通常状况呈液态的非金属单质是 ,地壳中含量最多的非金属元素是 。
(3)在原子序数为1~18号元素中,请用化学式填写。与水反应最剧烈的金属元素是 ; 元素的气态氢化物最稳定的物质是 ;元素的最高价氧化物所对应的酸其酸性最强的物质是 ;原子半径最大的金属与原子半径最小的非金属形成的化合物是 ,并用电子式表示其形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为元素周期表截取的短周期的一部分,即![]() 。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素在生产和生活中有广泛的应用
(1)P原子价电子排布图为_________。
(2)四(三苯基膦)钯分子结构如下图1:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为_________;判断该物质在水中溶解度并加以解释_________,该物质可用于图2所示物质A的合成:
物质A中碳原子杂化轨道类型为 _________;一个A分子中手性碳原子数目为 _________。
(3)在图3中表示出四(三苯基膦)钯分子中配位键:
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为_________;正四面体形阳离子中键角小于PCl3的键角原因为_________;该晶体的晶胞如右图4所示,立方体的晶胞边长为apm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3.
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com