
下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:一定条件下通入H2
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
③获得无水乙醇的方法通常是先用浓H2SO4吸水,然后再加热蒸馏
④除去乙醇中少量的水:加足量新制生石灰,蒸馏
| A.①② | B.②③ |
| C.③④ | D.②④ |
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:单选题
关于下列各实验装置图的叙述中,错误的是 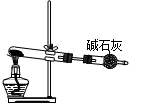
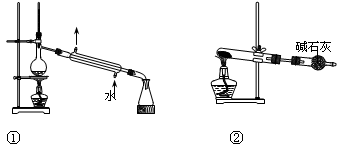
| A.①可用于分离苯和溴苯的混合物 | B.①可用于分离乙酸和乙醇的混合物 |
| C.②可用于分解NH4Cl制备NH3 | D.②可用于Ca(OH)2与NH4Cl共热制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中得无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是……( )
①原气体中肯定有SO2,②原气体中可能有SO2,③原气体中肯定没有H2S、HBr,④不能肯定原气体中是否含有HCl,⑤原气体中肯定无CO2,⑥原气体中肯定有HCl.
| A.①③④ | B.②④ | C.①③⑥ | D.①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
除去下列物质中所含少量杂质(括号内),所选用的试剂和分离方法能达到实验目的的是
| | 混合物 | 试剂 | 分离方法 |
| A | 蔗糖(葡萄糖) | 银氨溶液 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6区分开的试剂是
| A.FeCl3溶液 | B.稀硫酸 |
| C.酸性高锰酸钾溶液 | D.NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
莫尔盐【硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O】是一种重要化学试剂,实验室用含油污的铁片来制取莫尔盐,流程如下:
请回答下列问题:
(1)加入10%Na2CO3溶液的原因是___________________(用离子方程式表示)。
(2)A物质可以为________(填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)B物质的成分为_________________。
(4) 加少量硫酸调节pH为 1~2的目的是_____________________________,
操作Ⅱ的名称_______________________________________________。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是_________________________________________。
(6)鉴定所得晶体中含有Fe2+、NH 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入酸性KMnO4溶液,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下: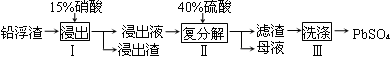
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式 、 。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是 。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是 (填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是 。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com