
【题目】金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)下列物质中不属于合金的是_______。
A.钢 B.青铜 C.黄铜 D.水银
(2)在钠、铝、铁三种金属元素中,所形成的氧化物中适宜做耐火材料的是_______,向盛有硫酸铝溶液的试管中滴加足量氨水,反应的离子方程式是_____________。
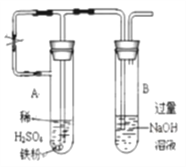
(3)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是_______。反应开始时,打开止水夹;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2。
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是____________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:__________;
(6)某研究性学习小组内测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是_______;②验证该溶液中含有Fe2+,正确的实验方法是_______;A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+C.观察溶液是否呈浅绿色
【答案】 D Al2O3 Al3++3NH3·H2O=3NH4++Al(OH)3↓ 加热煮沸 B B 2Fe3++Cu=Cu2++2Fe2+ Fe3+ A
【解析】分析:(1)合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质。据此分析解答;
(2)氧化铝熔点较高,所以氧化铝可以作耐火材料;铝离子与氨水反应生成氢氧化铝沉淀;
(3)硫酸亚铁易被氧化而变质,应排除溶液中的氧气,可用加热溶液的方法除去溶解氧;A管中产生的气体通入B管中排尽A、B管中的空气,使A、B充满还原性气体氢气,可防止生成的氢氧化亚铁被氧化;试管B中为NaOH溶液,将A中液体压到B中与其反应;
(4)根据金属性Fe>Cu以及氧化性Fe3+>Cu2+>Fe2+分析;
(5)根据氯化铁与铜反应生成氯化亚铁和氯化铜解答;
(6)根据铁离子能与KSCN溶液反应显红色分析;根据亚铁离子的性质解答。
详解:(1)A.钢是铁与碳元素的合金,A错误;B.青铜是铜和锡的合金,B错误;C.黄铜是铜和锌的合金,C错误;D.水银为汞单质,不是混合物,不属于合金,D正确;答案选D;
(2)适合作耐火材料的氧化物必须具有高熔点,氧化铝的熔点较高,所以氧化铝可以作耐火材料;铝离子和氨水反应生成氢氧化铝沉淀和铵根,离子反应方程式为Al3++3NH3·H2O=3NH4++Al(OH)3↓;
(3)获得不含O2的蒸馏水的方法是煮沸,简单易操作;反应开始时,要打开止水夹,利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,使整个装置不含氧气。在对B试管的出气管排出的氢气验纯之后,关闭止水夹,由于产生的氢气无法排出,试管A中的压强将增大,最终将A试管中生成的FeSO4溶液压入NaOH溶液中,故Fe(OH)2在B试管生成;
(4)A.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,A正确;B.加入铁和铜的混合物,铁首先与氯化铁反应,铜后参加反应,不会出现有铁无铜的情形,B错误;C.若氯化铁的量少,加入的铁粉和铜粉可能剩余,C正确;D.若氯化铁的量多,加入的铁粉和铜粉全部参加反应,不会有剩余,D正确;答案选B.
(5)氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(6)①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是Fe3+;②A.由于亚铁离子具有还原性,因此取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+,A正确;B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,不能证明原溶液中含有Fe2+,因为原溶液中可能含有铁离子,B错误;C.观察溶液是否呈浅绿色,不能确定是否含亚铁离子,C错误,答案选A。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是____(填元素符号,下同),第一电离能最小的是____;
(2)C所在的主族元素气态氢化物中,沸点最低的是____(填化学式);
(3)B元素可形成多种单质,其中”只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为______;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是____(填选项序号);

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是( )

A. Y的原子序数可能为a-17 B. Z的原子序数可能为a+31
C. X、Y、Z可能为短周期元素 D. Y与Z的原子序数之和可能为2a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料在人类文明史上起着划时代的意义。下列物品所用主要材料与类型的对应关系不正确的是
A.人面鱼纹彩陶盆——无机非金属材料B.“马踏飞燕”铜奔马——金属材料
C.宇航员的航天服——有机高分子材料D.光导纤维——复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙葵醛( )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):

(1)龙葵醛的分子式为_______,其中官能团的名称是__________;
(2)A物质的核磁共振氢谱中有_______个吸收峰,B的结构简式可能为_______。
(3)反应③的反应类型为_______,反应⑤的反应条件为_______。
(4)反应⑥的化学方程式为___________。
(5)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.能与Br2的CCl4发生加成反应。则符合上述条件的物质可能的结构有_______种。其中核磁共振氢谱为五组峰,峰面积比为1∶2∶2∶2∶3的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42﹣,CO32﹣等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )
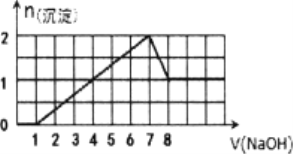
A. 原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+
B. 原溶液中含Fe3+和Al3+,物质的量之比为l:l
C. 原溶液中可能含有CO32﹣
D. 反应最后形成的溶液中含有的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国古代的四大发明之一,已知黑火药爆炸方程式S+2KNO3+3C═K2S+N2↑+3CO2↑,请问该反应中被硫氧化的碳和被硝酸钾氧化的碳的物质的量之比是( )
A. 1:3 B. 1:4 C. 1:5 D. 1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com