
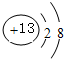 ,
,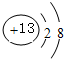 ;
;
| ||
| ||


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、只作氧化剂 |
| B、作催化剂 |
| C、既作氧化剂又作还原剂 |
| D、作干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol?L-1 Na2SO4溶液中含有SO42-物质的量为0.2 mol |
| B、50mL 2 mol?L-1 NaCl溶液和100mL 0.5mol?L-1MgCl2溶液中,Cl-的物质的量浓度相等 |
| C、用1 L水吸收22.4 L氯化氢(标况下)所得盐酸的浓度是1 mol?L-1 |
| D、10 g 98%的硫酸(密度为1.84g?cm-3)与10mL 18.4mol?L-1的硫酸的浓度是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、碳酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、可用丁达尔效应区分溶液与胶体 |
| D、CuSO4?5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44.8L |
| B、22.4L |
| C、11.2L |
| D、33.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
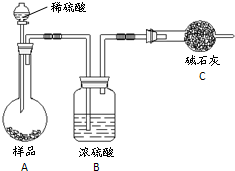
 锌与不同浓度的硫酸反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为101kPa,温度为0℃):
锌与不同浓度的硫酸反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为101kPa,温度为0℃):| a |
| 65 |
| b |
| 64+V |
| V |
| 22400 |
| n(H2) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 7 |
| 8 |
| X | Y | |
| Z | W |
| A、Y单质可与Z的氢化物的水溶液反应,使溶液pH升高 |
| B、含氧酸的酸性:W>Z |
| C、原子半径由大到小的排列顺序是Z>Y>X |
| D、X的单质中有一种为白色蜡状固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
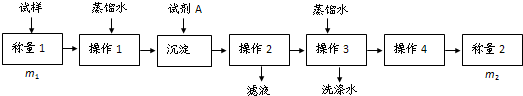
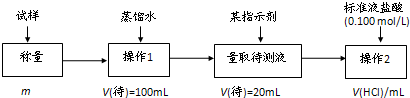
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com