
以知x为FeO和CuO的混合物,取两份等质量的x样品进行如图所示实验:
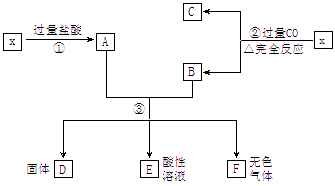
(1)写出第③步反应的离子方程式: 。
(2)实验从第③步所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6L。试计算取用的每份x中FeO与CuO的质量比。
(1)Fe+Cu2+=Fe2++ Cu Fe+2H+=Fe2++H2↑(2)9∶5
按图顺序正推,依次写出①~③的各步反应即得答案:
①FeO+2HCl=FeCl2+H2O CuO+2HCl=CuCl2+H2O
②FeO+CO ![]() Fe+CO2 CuO+CO
Fe+CO2 CuO+CO ![]() Cu+CO2
Cu+CO2
③Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2++H2↑
(2)由E为酸性溶液,可知固体D是铜单质。根据铜原子守恒,每份x中CuO的物质的量为:32g/64g·mol-1×1/2=0.25mol
其质量为:0.25mol×80g·mol-1=20g
每份x中FeO的物质的量为:0.25mol+5.6L/22.4L·mol-1=0.50mol
其质量为:0.50mol×72g·mol-1=36g
所以,每份x中FeO与CuO的质量比为:36g∶20g=9∶5


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
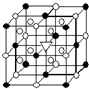 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
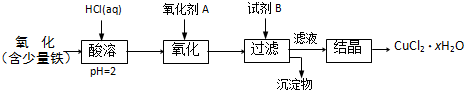
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com