
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 强酸性溶液中:K+、Cu2+、NO3-
B. 强碱性溶液中:Na+、NH4+、Cl-
C. 含1 mol·L-1 NH3·H2O的溶液中:K+、Al3+、SO42-
D. 含1 mol·L-1 Fe3+的溶液中:H+、Na+、SCN-
【答案】A
【解析】A. 强酸性溶液中含有大量的氢离子,K+、Cu2+、NO![]() 与H+间不能发生反应,能够大量共存,故A正确;B. 强碱性溶液中存在大量的OH-, NH与OH-能够反应生成NH3H2O,不能大量共存,故B错误;C. 1 mol·L-1 NH3·H2O的溶液中存在大量的OH-, Al3+与OH-能够反应生成氢氧化铝沉淀,不能大量共存,故C错误;D. Fe3+与SCN-能够反应生成难电离的物质,不能大量共存,故D错误;故选A。
与H+间不能发生反应,能够大量共存,故A正确;B. 强碱性溶液中存在大量的OH-, NH与OH-能够反应生成NH3H2O,不能大量共存,故B错误;C. 1 mol·L-1 NH3·H2O的溶液中存在大量的OH-, Al3+与OH-能够反应生成氢氧化铝沉淀,不能大量共存,故C错误;D. Fe3+与SCN-能够反应生成难电离的物质,不能大量共存,故D错误;故选A。
点晴:本题考查离子共存,为高频考点,侧重于学生的分析能力的考查,注意把握离子的性质以及反应类型的判断。本题的易错点是D,Fe3+和 SCN-能发生络合反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)基态锌原子的价电子排布式是_____________。
(2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。
(3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。
(4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(5)晶体Zn为六方最密堆积,其配位数是_______________。
(6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁一次氯酸钠热料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
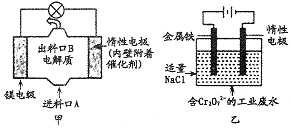
A. 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2
B. 图乙中惰性电极棒上有02放出
C. 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
D. 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(I)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)![]() 2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
A. z=2 B. 2 s后,容器内的压强是初始的7/8倍
C. 2 s后,B的浓度为0.5 mol/L D. 2 s时C的体积分数为2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
碱性氧化物 | 酸 | 盐 | |
A | CO2 | HCl | Na2CO3 |
B | CaO | NaHSO4 | KNO3 |
C | Al2O3 | HNO3 | CuSO4 |
D | MgO | H2SO4 | ZnCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键类型完全相同的时( )
A.CaCl2和 Na2S
B.Na2O 和Na2O2
C.CO2和 CaO
D.HCl 和NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com