
| A. | 在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:Fe3+、K+、Cl-、H+ | |
| C. | 在pH=12的溶液中:SO32-、CO32-、Na+、K+ | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、Na+ |
分析 A.碳酸氢根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
B.铁离子为有色离子,不满足溶液无色的条件;
C.pH=12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子、氢氧根离子反应.
解答 解:A.HCO3-、Al3+之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.无色溶液中不会存在有色的Fe3+,故B错误;
C.pH=12的溶液为碱性溶液,溶液中存在大量氢氧根离子,SO32-、CO32-、Na+、K+之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.加入Al能放出H2的溶液为酸性或强碱性溶液,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| C. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 | |
| D. | 除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 初始浓度c/(mol•L-1) | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 1.60 | 0.40 | 0.0020 | 580 |
| ② | 3.20 | 0.40 | 0.0020 | 290 |
| ③ | 1.60 | 0.80 | 0.0020 | 290 |
| ④ | 1.60 | 0.40 | 0.0040 | 1160 |
| A. | 由①④实验对比,可以得出增大c(Br2),v(Br2)减小 | |
| B. | 由②③实验对比,可以得出实验②和③的v(Br2)相等 | |
| C. | 由①③实验对比,可以得出增大c(HCl),v(Br2)增大 | |
| D. | 由①②实验对比,可以得出增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
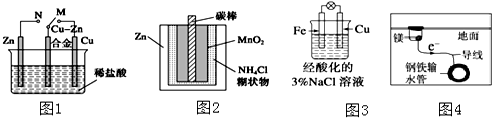
| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a大于0,P1小于P2 | |
| B. | M点H2O(g)的转化率为10% | |
| C. | M点化学反应速率大于N点 | |
| D. | 250℃时,用平衡分压计算的化学平衡常数 KP=$\frac{9}{16}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com