
【题目】A是相对分子质量为28的烃。以A为原料合成有机化合物D的方法如下图所示。

(1)A 的结构简式是_____________,A → B 的反应类型是_____________。
(2)B→C 反应的试剂及条件是_________________。
(3)C→D 反应的化学方程式是________________。
(4)写出C 和乙二酸在一定条件下合成高分子化合物的化学方程式:_________________。
【答案】CH2=CH2 加成反应 NaOH水溶液,加热 HOCH2CH2OH+HOOCCOOH![]() 2H2O+
2H2O+ nHOCH2CH2OH+nHOOCCOOH
nHOCH2CH2OH+nHOOCCOOH![]()
 +(2n-1)H2O
+(2n-1)H2O
【解析】
A是相对分子质量为28的烃,利用商余法,28除以12,商是2,余数是4,则A的分子式为C2H4,是乙烯,其结构简式为CH2=CH2。乙烯与Br2发生加成,生成1,2-二溴乙烷,CH2BrCH2Br,它在NaOH水溶液中发生水解,-Br转化为-OH,C为HOCH2CH2OH,与乙二酸发生酯化反应得到D。
(1).A为乙烯,其结构简式为CH2=CH2;A与Br2发生加成反应生成B,A→B的反应类型是加成反应;
(2)1,2-二溴乙烷在NaOH水溶液中发生水解得到C,反应条件为NaOH水溶液,加热;
(3)C为乙二醇,D为乙二酸,反生酯化反应得到D,化学方程式为HOCH2CH2OH+HOOCCOOH![]() 2H2O+
2H2O+ ;
;
(4)C为乙二醇,D为乙二酸,在一定条件下合成高分子化合物,化学方程式为nHOCH2CH2OH+nHOOCCOOH![]()
 +(2n-1)H2O。
+(2n-1)H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨转化为1 mol金刚石要吸收能量,则1 mol石墨的能量比1 mol金刚石的能量____(填“高”或“低”),石墨比金刚石_______(填“稳定”或“不稳定”)。
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是____________,该反应是___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
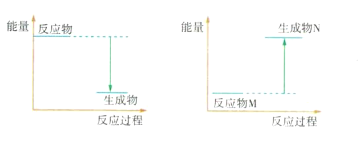
图1 图2
(4)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___________________________。
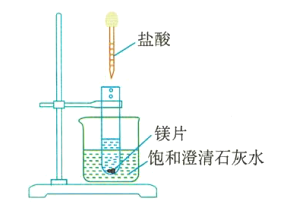
图3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为__________________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是______(填标号)。
A.中心原子的价层电子对数目相等B.都是非极性分子C.中心原子的孤电子对数目相等D.都含有极性键E.都能与Na2O反应F.固态时晶体类型不同
(4)D在空气中燃烧的产物分子构型为______。固体DB3中存在如图(b)所示的三聚分子,该分子中D原子的杂化轨道类型为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种原色的一种单核微粒的结构示意图时,忘记在圆圈内标出其核电荷数,请你根据下面的提示做出自己的判断。
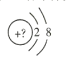
(1)若该微粒是电中性微粒,这种微粒的元素符号是_____________。
(2)若该微粒的还原性很弱,失去1个电子后变为原子,该原子的单质氧化性很强,该单质与水反应的 化学方程式为______________。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,该原子的单质还原性很强,该单质在氧气中燃烧所得产物的化学式为_______________。
(4)若该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式为_____________。
(5)若该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
![]() 活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入
活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入![]() NO和
NO和![]() 固体活性炭
固体活性炭![]() 无杂质
无杂质![]() ,生成气体E和气体
,生成气体E和气体![]() 当温度分别在
当温度分别在![]() 和
和![]() 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
| 活性炭 | NO | E | F |
|
|
|
|
|
|
|
|
|
|
![]() 结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______ ,根据上述信息判断,
______ ,根据上述信息判断,![]() 和
和![]() 的关系是 ______ ;
的关系是 ______ ;
A.![]() B.
B.![]() C.无法比较
C.无法比较
![]() 在
在![]() 下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
![]() 增大
增大![]()
![]() 增大压强
增大压强![]() 升高温度
升高温度![]() 移去部分F
移去部分F
![]() 碘循环工艺不仅能吸收
碘循环工艺不仅能吸收![]() 降低环境污染,同时又能制得
降低环境污染,同时又能制得![]() ,具体流程如图所示
,具体流程如图所示

![]() 用离子方程式表示反应器中发生的反应 ______ ;
用离子方程式表示反应器中发生的反应 ______ ;
![]() 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出
用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出![]() 的目的是 ______ ;
的目的是 ______ ;
![]() 开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池
开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示

通过a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,b电极反应式为 ______ .
,b电极反应式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为![]() ,请回答下列问题.
,请回答下列问题.
(1)A中所含官能团的名称是_______、______;
(2)A可能发生的反应有______(填序号);
①取代反应 ②消去反应 ③水解反应 ④酯化反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量![]() ,较多的
,较多的![]() 及部分污泥,通过下列流程可从该废水中回收
及部分污泥,通过下列流程可从该废水中回收![]() 晶体及金属Cu。
晶体及金属Cu。

![]() 固体混合物是______
固体混合物是______![]() 填化学式
填化学式![]() ,试剂乙为______
,试剂乙为______![]() 填物质名称
填物质名称![]()
![]() 步骤3中发生反应的离子方程式为______
步骤3中发生反应的离子方程式为______
![]() 步骤4中涉及的操作是:蒸发浓缩、______、过滤、洗涤、干燥;蒸发浓缩、过滤操作中均用到的玻璃仪器是______
步骤4中涉及的操作是:蒸发浓缩、______、过滤、洗涤、干燥;蒸发浓缩、过滤操作中均用到的玻璃仪器是______
![]() 粗铜中常混有少量氧化亚铜
粗铜中常混有少量氧化亚铜![]() ,氧化亚铜与稀硫酸反应,会产生单质铜,同时溶液变蓝。试写出该反应的离子方程式______。
,氧化亚铜与稀硫酸反应,会产生单质铜,同时溶液变蓝。试写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A. 常温下,1L pH=13的Ba(OH)2溶液中OH-数为0.2NA
B. 2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C. 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
D. 0.lmol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子或分子在溶液中能大量共存,且满足相应要求的是( )
选项 | 离子或分子 | 要求 |
A | K+、SO | c(K+)=2c(SO |
B | Fe3+、Na+、NO | 溶液pH=1 |
C | NH | 滴加NaOH溶液马上有气泡产生 |
D | Na+、Al3+、Cl-、SO | 滴加氨水立即有沉淀产生 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com