
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A.②⑧B.①⑥C.②④D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置探究金属锌和稀硫酸的反应,实验过程中电流表的指针发生偏转。请回答下列问题:
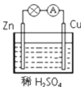
(1)锌片做电池的__________极(填“正或负”),发生的电极反应式:__________。
(2)铜片的现象是__________,发生的电极反应式:__________。
(3)若将稀H2SO4换成CuSO4,则正极反应式为:__________。
(4)若将电极换成铁片和铜片,则负极是__________(填“铁片或铜片”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为![]() 制备原料为
制备原料为![]() 、
、![]() 和
和![]() ,电解液为
,电解液为![]() 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______![]() 用元素符号表示
用元素符号表示![]() 。
。
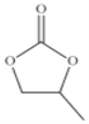
(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为______,1mol碳酸丙烯酯中σ键的数目为______。
![]() 的几何构型为正八面体形,配体是______,该配离子包含的作用力为______
的几何构型为正八面体形,配体是______,该配离子包含的作用力为______![]() 填选项字母
填选项字母![]() 。
。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则Na与O之间的最短距离为_______________________
,则Na与O之间的最短距离为_______________________ ![]() 用含ρ、
用含ρ、![]() 的代数式表示
的代数式表示![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常温下电解质溶液的叙述中,正确的是( )
A.向![]()
![]() 溶液中加入等体积
溶液中加入等体积![]() NaOH溶液,测得溶液中
NaOH溶液,测得溶液中![]() ,则水的电离程度比纯水的大
,则水的电离程度比纯水的大
B.![]() 时,
时,![]() 的
的![]() 溶液中由水电离出的
溶液中由水电离出的![]()
C.等物质的量浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 前者小于后者
前者小于后者
D.等物质的量浓度、等体积的氨水和盐酸混合后,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,1 mol A(g)与1 mol B(g)在催化剂作用下加热到500 ℃发生反应:A(g)+nB(g)![]() C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
A.升高温度v(正)增大,v(逆)减小,平衡向正反应方向移动
B.平衡后再加入1 mol B,上述反应的ΔH增大
C.当n<1时,通入惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.异丙苯(![]() )中所有碳原子不全在同一平面上
)中所有碳原子不全在同一平面上
B.乙烯与乙醇都能使酸性KMnO4溶液褪色
C.![]() 与
与![]() 互为同分异构体,且二氯代物均为6种
互为同分异构体,且二氯代物均为6种
D.苯的硝化和乙酸的酯化反应都是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备K2FeO4的实验装置图,其中甲为制氯气的装置。(资料:K2FeO4为紫色固体,微溶于KOH,具有强氧化性)
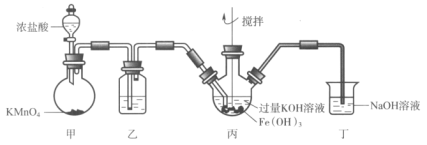
下列说法不正确的是( )
A.乙中所用试剂为饱和食盐水
B.丙和丁中均会发生反应:Cl2+2OH-=Cl-+ClO-+H2O
C.丙中产生紫色固体,说明碱性条件下,Cl2氧化性强于K2FeO4
D.若取反应后丙中紫色溶液,加入稀硫酸产生Cl2,则证明了K2FeO4具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
(1)海水中无机碳的存在形式及分布如下图所示:
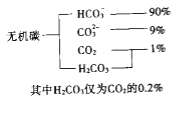
用离子方程式表示海水呈弱碱性的原因______________.已知春季海水pH=8.1,预测夏季海水碱性将会_____________(填写“增强”或“减弱”),理由是_________________________.
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________.
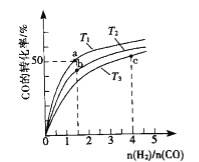
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
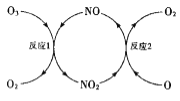
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________。
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________;c点所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).
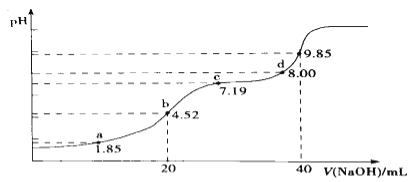
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com