
| A. | 非金属元素原子组成的化合物不可能是离子化合物 | |
| B. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| C. | 同一主族元素组成的化合物一定是共价化合物 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1 mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
分析 A.非金属元素组成的化合物可能是离子化合物;
B.IA族元素的金属性不一定比IIA族元素的金属性强;
C.同一主族元素形成的化合物可能是离子化合物;
D.NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,为NH4H,铵根离子中含有4个N-H键.
解答 解:A.非金属元素组成的化合物可能是离子化合物,如铵盐,故A错误;
B.IA族元素的金属性不一定比IIA族元素的金属性强,如Li的金属性小于Ba,故B错误;
C.同一主族元素形成的化合物可能是离子化合物,如NaH,故C错误;
D.NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,为NH4H,铵根离子中含有4个N-H键,所以1 mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值),故D正确;
故选D.
点评 本题考查化合物结构,侧重考查学生分析判断能力,明确物质的构成微粒及微粒之间作用力即可解答,采用举例法分析解答,易错选项是D.


科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
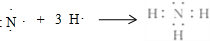 .写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室制取该物质的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 改变的条件 | 正、逆反应速率变化 | 新平衡与原平衡比较 | |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | X的体积分数增大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定 量的Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的稳定性介于Na2CO3•10H2O和NaHCO3之间 | |
| B. | “侯氏制碱法”制得的碱是指NaHCO3 | |
| C. | 可用盐酸鉴别Na2CO3 和NaHCO3固体 | |
| D. | 纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 只要符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| C. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

 的名称是3-甲基-1-丁醇
的名称是3-甲基-1-丁醇| A. | ①③④ | B. | ①⑤⑥ | C. | ③④ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙炔 | C. | 丙烯 | D. | 丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com