
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
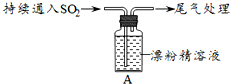 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
分析 (1)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(2)依据次氯酸根离子和氯离子在酸溶液中会发生归中反应生成氯气,向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(3)二氧化硫通入漂白精溶液中,形成酸溶液,次氯酸根离子具有强氧化性可以氧化二氧化硫为硫酸和钙离子形成硫酸钙沉淀;二氧化硫继续通入后和生成的氯气发生反应生成硫酸和盐酸.
解答 解:(1)向水中持续通入SO2,未观察到白雾.推测现象的白雾由HCl小液滴形成,
①用湿润的碘化钾淀粉试纸检验白雾,无变化;为了检验白雾中是否含有氯气,因为含有氯气在检验氯化氢存在时产生干扰,
故答案为:检验白雾中是否含有Cl2,排除Cl2干扰;
②用酸化的AgNO3溶液检验白雾,产生白色沉淀,若含有二氧化硫气体,通入硝酸酸化的硝酸银溶液,会被硝酸氧化为硫酸,硫酸和硝酸银反应也可以生成硫酸银沉淀,所以通过实验不能证明一定含有氯化氢,
故答案为:白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,漂粉精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,
故答案为:向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
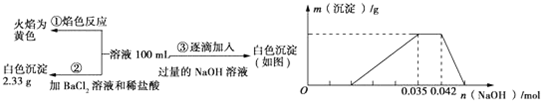
(3)①取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸;反应的离子方程式为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+,
故答案为:CaSO4:SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
点评 本题考查了二氧化硫性质的综合应用,性质的实验验证方法和实验判断,漂白精的成分中次氯酸钙和氯化钙在酸溶液中会发生氧化还原反应生成氯气,注意物质的检验方法,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | Na2CO3溶液比NaHCO3溶液碱性强 | |
| D. | 碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g NH3中含有的电子总数为10NA | |
| B. | 常温常压下,14g的C2H4和C3H6混合气体含有的氢原子数为2NA | |
| C. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| D. | 标准状况下,22.4 L 的N2O和CO2混合气体中含有的电子总数为22NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: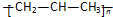 | B. | 二氧化碳的电子式: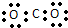 | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
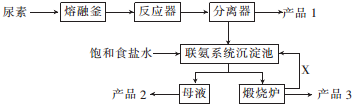
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
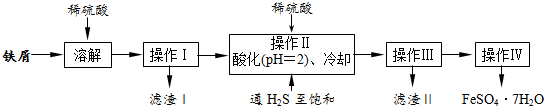
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com