
| A�� | pH=1��NaHSO4��Һ��c��Na+��+c��H+��=c��SO42-��+c��OH-�� | |
| B�� | ��10mL pH=l2��NaOH��Һ�еμӵ����pH=2��CH3COOH��c��CH3COO-����c��Na+����c��OH-����C��H+�� | |
| C�� | 0.10 mol•L-1 NaHCO3��Һ��ˮϡ�ͺ�n ��H+����n ��OH-���ij˻���� | |
| D�� | 0.1mol/LNH4Cl��0.1mol/L��ˮ����������Һ�Լ��ԣ�c��NH3•H2O����c��NH4+����c��Cl-����c��OH-�� |
���� A���������غ���д����ȫ��������ע�������ǹؼ�����������H+��Na+����������SO42-��OH-��
B��pH=l2��NaOH��Һ������pH=2��CH3COOH��Һ��ϣ���Һ�е�����ΪCH3COONa��
C����ˮϡ�ͣ��ٽ�ˮ��ƽ�������ƶ���ʹˮ�ĵ���̶���������H+��OH-��Ŀ���ࣻ
D���Ȼ����ǿ�������Σ�笠�����ˮ�������ԣ�ˮ�����ӷ���ʽΪ��NH4++H2O?NH3•H2O+H+��ע�ⰱˮ�ĵ������笠����ӵ�ˮ�⣮
��� �⣺A����������H+��Na+����������SO42-��OH-�����ݵ���غ㣬NaHSO4��Һ��c��Na+��+c��H+��=2c��SO42-��+c��OH-������A����
B��pH=l2��NaOH��Һ������pH=2��CH3COOH��Һ��ϣ���Һ�е�����ΪCH3COONa������CH3COO-ˮ��ʼ��ԣ���c��CH3COO-����c��Na+������B����
C��NaHCO3��Һ��ˮϡ�ͣ��ٽ�ˮ�⣬ʹˮ�ĵ���̶���������H+��OH-��Ŀ���࣬n��H+����n��OH-���ij˻����C��ȷ��
D���Ȼ����ǿ�������Σ�笠�����ˮ�������ԣ�ˮ�����ӷ���ʽΪ��NH4++H2O?NH3•H2O+H+����ˮ�ĵ������笠����ӵ�ˮ�⣬��ˮ���Ũ�ȣ�ˮ�������Ũ�ȣ��������ӣ��������ӣ���������Ũ�ȴ�СΪ��c��NH4+����c��Cl-����c��NH3•H2O����c��OH-������D����
��ѡC��
���� ���⿼��ѧ���ε�ˮ��ԭ����Ӧ���Լ�����Ũ�ȴ�С�Ƚϵȷ����֪ʶ�������ۺ�֪ʶ�Ŀ��飬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ڷǽ�����Y��R����X��Y��ɻ�����ķе����X��R��ɵĻ����� | |
| B�� | ��Z��Y�γɵ��������ӻ��������������ӵĸ����ȷֱ�Ϊ1��2��1��1 | |
| C�� | ԭ�Ӱ뾶�ɴ�С���е��ǣ�Z��R��W��Y��X | |
| D�� | Y��Z��W����Ԫ����ɻ������ˮ��Һһ���Լ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
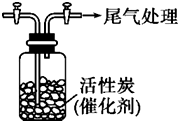 ijѧϰС������SO2���л�ԭ�ԣ��Ʋ�SO2�ܱ�Cl2��������SO2Cl2���������ϣ�SO2Cl2�ڳ�����Ϊ��ɫҺ�壬����ˮ�⣬����ʪ���������������
ijѧϰС������SO2���л�ԭ�ԣ��Ʋ�SO2�ܱ�Cl2��������SO2Cl2���������ϣ�SO2Cl2�ڳ�����Ϊ��ɫҺ�壬����ˮ�⣬����ʪ����������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���壮 CO��NH2��2+H2O��ʱ��̼��=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ40%��
CO��NH2��2+H2O��ʱ��̼��=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ40%���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C57H104O6 | B�� | C57H108O6 | C�� | C57H106O6 | D�� | C57H102O6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������γ��뻯ʯȼ�ϵ�ȼ���й� | |
| B�� | ���ϲ����������������������PM2.5����Ⱦ | |
| C�� | �������������г������ƿɹ۲쵽�����ЧӦ | |
| D�� | ������ҵ��Դ�ṹ���ƹ������Դ��ʹ�ã�����Ч�ؼ���PM2.5����Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��� | ʵ����� | ʵ������ | ʵ����� |
| 1 | ��þ��Ͷ��5ml����ˮ | ������ | |
| 2 | ��þ��Ͷ��5ml����NaHCO3��Һ�� | Mg��NaHCO3��Һ���ҷ�Ӧ | |
| 3 | ��þ��Ͷ��5ml pH=8.4NaOH��Һ�� | �������� | Mg��NaOH��Һ���ѷ�Ӧ |
ʵ�鲽�� | ����ͽ��� |
| ���Թ��м����ȥ����Ĥ��þ�� ����̼�����Ʊ�����Һ����ʪ��ĺ�ɫʯ����ֽ����ƿ�ڼ��� | ����ֽ��죬��������CO2����ֽ����죬��������CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2CH2CH2CH2Cl | B�� | CH3CH2CHClCH2CH3 | ||
| C�� | 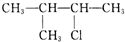 | D�� | 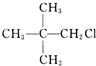 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com