
【题目】某无色混合物水溶液,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Ba2+、Cl-、CO32-、SO42-。取100mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;
试回答下列问题:
(1)肯定存在的离子有______________________________,肯定不存在的离子有___________________________________;
(2)可能存在的离子是__________________________________________________,判断该离子存在与否的方法是______________________________________________________________________________________________________________________________________;
(3)肯定存在的阳离子在原溶液中的物质的量浓度至少为_______________________________________________。
【答案】 CO32-、SO42-、K+ Mg2+、Fe3+、Ba2+ Cl— 取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有 c(K+)至少为0.7 mol/L
【解析】某无色混合物水溶液,含Fe3+的溶液呈棕黄色,则该水溶液中一定不含有Fe3+离子,向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体,气体应该为二氧化碳,且物质的量为![]() =0.025mol,则溶液中一定含CO32-,且物质的量为0.025mol;碳酸镁微溶、碳酸钡难溶,CO32-与Mg2+、Ba2+不能大量共存,故溶液中一定不含Mg2+离子,向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;则应该还含有SO42-离子且物质的量为
=0.025mol,则溶液中一定含CO32-,且物质的量为0.025mol;碳酸镁微溶、碳酸钡难溶,CO32-与Mg2+、Ba2+不能大量共存,故溶液中一定不含Mg2+离子,向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;则应该还含有SO42-离子且物质的量为![]() =0.01mol,根据溶液电中性的原则,溶液中还应该有阳离子,而排除Mg2+、Fe3+、Ba2+以外,溶液中一定含有K+离子;综上所得:(1)肯定存在的离子有CO32-、SO42-、K+;肯定不存在的离子有Mg2+、Fe3+、Ba2+;题中没有涉及Cl—的检验,故(2)可能存在的离子是Cl—,判断该离子存在与否的方法是取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有;(3)CO32-物质的量为0.025mol;SO42-离子物质的量为0.01mol,根据电荷守恒,肯定存在的阳离子K+在原溶液中的物质的量至少为2×(0.025mol +0.01mol)=0.07mol,溶液的体积为100mL,则K+的浓度为:
=0.01mol,根据溶液电中性的原则,溶液中还应该有阳离子,而排除Mg2+、Fe3+、Ba2+以外,溶液中一定含有K+离子;综上所得:(1)肯定存在的离子有CO32-、SO42-、K+;肯定不存在的离子有Mg2+、Fe3+、Ba2+;题中没有涉及Cl—的检验,故(2)可能存在的离子是Cl—,判断该离子存在与否的方法是取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有;(3)CO32-物质的量为0.025mol;SO42-离子物质的量为0.01mol,根据电荷守恒,肯定存在的阳离子K+在原溶液中的物质的量至少为2×(0.025mol +0.01mol)=0.07mol,溶液的体积为100mL,则K+的浓度为: ![]() =0.7mol/L。
=0.7mol/L。


科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:___________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________。要除去该物质,可先在混合液中加入________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
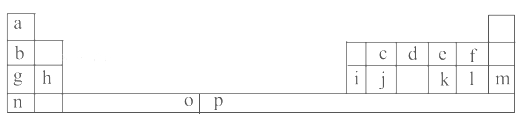
试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
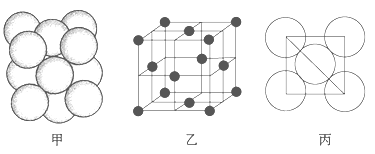
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的钠铝合金置于水中,合金全部溶解,得到 20mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示:

写出有关反应的化学方程式:
(1)______________________________ ;(2)______________________________;
(3)______________________________ ;(4)____________________________ ;
(5)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是 ( )

A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. 简单离子的半径由大到小为:E>A>B>C
D. D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种元素A、B、C、D,它们的原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。回答下列问题:
(1)上述元素可以形成多种具有漂白性的物质,请写出任意两种物质的化学式:_________,______________;
(2)C与D形成D的最低价化合物的电子式:_________ ;
(3)写出C与水反应的离子方程式:______________________________;
(4)A、B组成的物质E可形成甲、乙两种微粒,它们均有10个电子。写出E生成甲、乙的方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将以下4份溶液分别置于如图的装置中,其它条件相同时,灯泡最亮的是( )
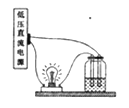
A. 80mL 1mol/L的NaCl溶液
B. 30mL 2mol/L的AlCl3溶液
C. 50mL 2mol/L的氨水
D. 60mL 2mol/L的蔗糖溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.葡萄糖和麦芽糖属于还原性糖
B.用新制的银氨溶液可区分甲酸和乙醛
C.乙烯和苯都能使溴水褪色,褪色的原因相同
D.淀粉和纤维素的化学式均为(C6H10O5)n,两者都能在人体内水解生成葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com