

分析 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,由转化关系可知,B、E为短周期元素组成,
(1)若F是一种金属单质,由转化关系可知,F为变价金属,应为Fe,B与Fe反应生成高价Fe,由于A为有色气体,与水反应生成B与E,则A为二氧化氮,B为硝酸、E为NO,C为硝酸铜、D为硝酸亚铁;
(2)A为双原子分子,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为碳酸钠、C为二氧化碳、D为碳酸氢钠;
(3)A为淡黄色固体,能与水反应,则A为过氧化钠,与水反应生成氢氧化钠和氧气,
①若物质B和D的相对分子质量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题,结合转化关系,B为氧气、F为硫化氢、C为二氧化硫、D为硫;
②若物质A和D的相对分子质量相等,D为白色絮状沉淀,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氢氧化铝、E为氧气.
解答 解:A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,由转化关系可知,B、E为短周期元素组成,
(1)已知常温下A为有色气体,若F是一种金属单质,由转化关系可知,F为变价金属,应为Fe,B与Fe反应生成高价Fe,由于A为有色气体,与水反应生成B与E,则A为二氧化氮,B为硝酸、E为NO,C为硝酸铜、D为硝酸亚铁.则B和适量F反应生成C与气体E的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若A为双原子分子,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为碳酸钠、C为二氧化碳、D为碳酸氢钠,
故答案为:Na2CO3;
(3)A为淡黄色固体,能与水反应,则A为过氧化钠,与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
①若物质B和D的相对分子质量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题,结合转化关系,B为氧气、F为硫化氢、C为二氧化硫、D为硫,C与F反应的化学方程式为:SO2+2H2S=3S+2H2O,
故答案为:SO2+2H2S=3S+2H2O;
②若物质A和D的相对分子质量相等,D为白色絮状沉淀,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氢氧化铝、E为氧气,C与F反应离子方程式表为:3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓.
点评 本题考查无机物推断,题目难度中等,熟练掌握元素化合物的性质是关键,侧重考查学生对常见物质性质与特殊反应考查,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯催化加氢后得到3,3-二甲基-丁烷 | |
| B. | 2-甲基-1,3-丁二烯与Br2的加成产物有3种 | |
| C. | 根据所有原子不在同一平面上可以说明C4H6的某烃是1-丁炔而不是CH2=CH-CH=CH2 | |
| D. | 已知具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的溶质质量分数变大 | B. | 溶液仍为饱和溶液 | ||
| C. | 溶液中的Na+数目减小 | D. | 溶液中的c(Na+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
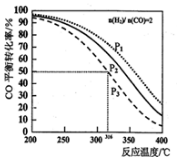
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8kJ•mol-1 | |
| C. | 对反应b来说,增大O2浓度可使△H2的值增大 | |
| D. | 以上两种途径,制取等量的氢气,无论哪种途径,消耗的能量均相同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com