
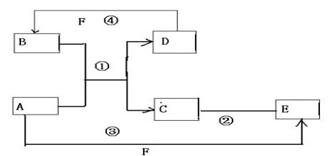
 ��Ӧ?�ٵĻ�ѧ����ʽ2NH3+3Cl2=N2+6HCl
��Ӧ?�ٵĻ�ѧ����ʽ2NH3+3Cl2=N2+6HCl���� ��1��A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬A��F����Ԫ��ͬ���ڣ���AΪC��DΪSi��FΪO2��BΪSiO2����Ӧ��ΪC���������ķ�Ӧ��
��2����A�dz����Ľ����ĵ��ʣ�D��F����̬���ʣ�A��Fe����Ӧ�١���Ӧ�ڶ�����ˮ��Һ�н��У���B���ᣬC���Σ�D��F��Ӧ�����ᣬ�κ����嵥��F��Ӧ����E��Fe�����嵥��ֱ�ӷ�Ӧ����E����F��Cl2��E��FeCl3��C��FeCl2��B��HCl��D��H2��
��3����B��C��F������̬���ʣ���B�ж�����Ӧ����Ҫ�ŵ���ܷ�����A��D�����а������ɣ���BΪCl2
��CΪN2��FΪO2��AΪNH3��DΪHCl��
��4����A��DΪ������Ԫ�ص��ʣ�������Ԫ�ص�ԭ������A��D��2������Aԭ��������ż��������Ԫ�ص�ԭ������������D��A��2����A����������С��4��Ϊż����Dλ�ڵڶ����ڡ�Aλ�ڵ������ڣ���A��Mg��D��CԪ�أ�F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ�����ɫ������NO2����F��HNO3��C��HNO3Ũ��Һ��Ӧ����CO2��NO2��H2O��B�ܺ�Mg��Ӧ����̼���ʣ���B��CO2��C��MgO��MgO�����ᷴӦ����Mg��NO3��2��H2O��Mg�����ᷴӦ����Mg��NO3��2����E��Mg��NO3��2��
��� �⣺��1��A��D��F���Ƕ����ڷǽ���Ԫ�ص��ʣ���A��D����Ԫ��ͬ���壬A��F����Ԫ��ͬ���ڣ���AΪC��DΪSi��FΪO2��BΪSiO2����Ӧ��ΪC���������ķ�Ӧ����Ӧ����ʽΪ��2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO����
�ʴ�Ϊ��2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO����
��2����A�dz����Ľ����ĵ��ʣ�D��F����̬���ʣ�A��Fe����Ӧ�١���Ӧ�ڶ�����ˮ��Һ�н��У���B���ᣬC���Σ�D��F��Ӧ�����ᣬ�κ����嵥��F��Ӧ����E��Fe�����嵥��ֱ�ӷ�Ӧ����E����F��Cl2��E��FeCl3��C��FeCl2��B��HCl��D��H2����Ӧ����ˮ��Һ�н��з�Ӧ�������ӷ���ʽ�ǣ�2Fe2++Cl2�T2Fe3++2Cl-��
�ʴ�Ϊ��2Fe2++Cl2�T2Fe3++2Cl-��
��3����B��C��F������̬���ʣ���B�ж�����Ӧ����Ҫ�ŵ���ܷ�����A��D�����а������ɣ���BΪCl2
��CΪN2��FΪO2��AΪNH3��DΪHCl����C�ĵ���ʽΪ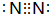 ����Ӧ?�ٵĻ�ѧ����ʽ��2NH3+3Cl2=N2+6HCl��
����Ӧ?�ٵĻ�ѧ����ʽ��2NH3+3Cl2=N2+6HCl��
�ʴ�Ϊ��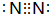 ��2NH3+3Cl2=N2+6HCl��
��2NH3+3Cl2=N2+6HCl��
��4����A��DΪ������Ԫ�ص��ʣ�������Ԫ�ص�ԭ������A��D��2������Aԭ��������ż��������Ԫ�ص�ԭ������������D��A��2����A����������С��4��Ϊż����Dλ�ڵڶ����ڡ�Aλ�ڵ������ڣ���A��Mg��D��CԪ�أ�F��Ũ��Һ��A��D��Ӧ���к���ɫ�������ɣ�����ɫ������NO2����F��HNO3��C��HNO3Ũ��Һ��Ӧ����CO2��NO2��H2O��B�ܺ�Mg��Ӧ����̼���ʣ���B��CO2��C��MgO��MgO�����ᷴӦ����Mg��NO3��2��H2O��Mg�����ᷴӦ����Mg��NO3��2����E��Mg��NO3��2��
B�ĽṹʽΪO=C=O����Ӧ?�ܵĻ�ѧ����ʽΪ��C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+4NO2��+2H2O��
�ʴ�Ϊ��O=C=O��C+4HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CO2��+4NO2��+2H2O��
���� ���⿼�������ƶϣ����ڲ²�����Ŀ����Ҫѧ����������Ԫ�ػ�����֪ʶ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ǿ������Һ��Mg2+��NH4+��Cl-��NO3- | |
| B�� | ʹ���ȱ�����Һ��Na+��Fe3+��Cl-��S2O32- | |
| C�� | ��ɫ��Һ�У�K+��Al3+��HCO3-��Cr2O72- | |
| D�� | �����£�$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��10-12����Һ��K+��Na+��AlO2-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
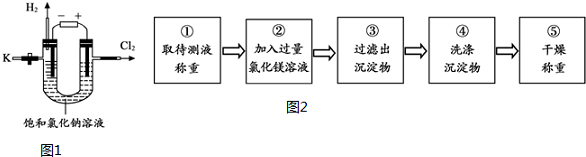
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2S��I2��Fe3+��Cl2 | B�� | Cl2��Fe3+��I2��H2S | ||
| C�� | Fe3+��Cl2��H2S��I2�� | D�� | Cl2��I2��Fe3+��H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
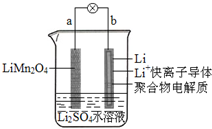 2013��3���ҹ���ѧ�ұ�������ͼ��ʾ��ˮ��Һ����ӵ����ϵ����������������ǣ�������
2013��3���ҹ���ѧ�ұ�������ͼ��ʾ��ˮ��Һ����ӵ����ϵ����������������ǣ�������| A�� | aΪ��ص����� | |
| B�� | ��طŵ練ӦΪLiMn2O4=Li1-xMn2O4+xLi | |
| C�� | �ŵ�ʱ��a��﮵Ļ��ϼ۲������仯 | |
| D�� | �ŵ�ʱ����Һ�е�Li+��b��aǨ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com