

| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
分析 实验探究硝酸与铁反应的产物流程:连接装置后,先检查装置的气密性,然后打开弹簧夹,通入一段时间CO2,关闭弹簧夹,排除反应体系中的空气,防止对产物中有无一氧化氮判断的干扰,A装置:打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞,硝酸与铁反应,A中有红棕色气体产生NO2,一段时间后,气体颜色逐渐变浅,B装置:B中溶液变棕色,发生反应FeSO4+NO?Fe(NO)SO4(棕色);C装置:尾气吸收,NO2和NO都能被KMnO4氧化吸收.
(1)依据常温下铁在浓硝酸中发生钝化分析,常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生;
(2)装置内空气不排除,会干扰一氧化氮判断;
(3)B中溶液变棕色,说明B中有Fe(NO)SO4生成,反应FeSO4+NO?Fe(NO)SO4(棕色)的正反应是放热反应,升高温度平衡向逆反应移动,棕色溶液变浅(或绿),生成的NO与氧气反应生成二氧化氮,气体在空气中变为红棕色;
(4)铜和浓硝酸反应生成红棕色气体二氧化氮,二氧化氮和水反应生成一氧化氮,一氧化氮能使硫酸亚铁溶液变成棕色,所以不能证明铁和浓硝酸反应过程中NO生成,为排除生成的NO干扰,把浓硝酸换成稀硝酸,如果硫酸亚铁溶液再变成棕色则说明有NO生成;
(5)Fe2+和铁氰化钾溶液反应生成特征蓝色沉淀;依据氧化还原反应,结合化学方程式定量关系计算得到,2Fe3++2I-=2Fe2++I2;2S2O32-~I2~2Fe3+.
解答 解:(1)常温时,铁和浓硝酸反应生成一层致密的氧化物薄膜,阻止了铁和浓硝酸进一步反应,即产生钝化现象,所以滴入浓硝酸加热前没有明显现象,
故答案为:常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生;
(2)浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物,可能有NO生成,NO易与氧气反应生成二氧化氮,所以需用二氧化碳排除反应体系中的空气,防止对产物中有无一氧化氮判断的干扰,
故答案为:排除反应体系中的空气,防止对产物中有无一氧化氮判断的干扰;
(3)取少量B中溶液,加热,棕色溶于变浅,有无色气体逸出,且该气体在空气中变为红棕色,应为可逆反应FeSO4+NO?Fe(NO)SO4(棕色)是放热反应,升高温度,平衡向逆反应方向移动,导致Fe(NO)SO4(棕色)降低,所以溶液颜色变浅,
故答案为:FeSO4+NO?Fe(NO)SO4(棕色)△H<0,正反应放热,加热后,平衡向逆反应方向移动;
(4)二氧化氮和水反应生成的一氧化氮能使硫酸亚铁溶液变成棕色,所以不能证明铁和浓硝酸反应过程中NO生成,为排除生成的NO干扰,把浓硝酸换成稀硝酸,稀硝酸和铜反应生成无色的一氧化氮,没有二氧化氮生成,则A中气体是无色的,且B中溶液变为棕色,则说明生成的一氧化氮和硫酸亚铁反应生成棕色,从而说明A中无色气体是一氧化氮,
故答案为:A中没有红棕色气体生成,B中溶液变为棕色;
(5)Fe2+和铁氰化钾溶液反应3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀),生成特征蓝色沉淀,所以由此证明A溶液中含有Fe2+,I2+2S2O32-=2I-+S4O62-,2Fe3++2I-=2Fe2++I2;
2S2O32-~I2~2 Fe3+;
2 2
0.25×16×10-3mol n(Fe3+)
n(Fe3+)=4×10-3mol,则A中所得溶液的c(Fe3+)=$\frac{4×1{0}^{-3}mol}{25×1{0}^{-3}L}$=0.16mol/L,
故答案为:Fe2+;0.16.
点评 本题考查铁、硝酸的性质,亚铁离子的检验和计算是高考热点,注意:常温时,铁和浓硝酸不是不反应,而是发生了钝化现象,阻止了进一步反应,为易错点,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
 按要求填空:
按要求填空: ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
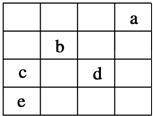 如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )| A. | 元素c和d的最高价氧化物对应水化物的酸性:c>d | |
| B. | 五种元素中,元素e的性质最稳定 | |
| C. | 元素b位于ⅥA族,有+6、-2两种常见化合价 | |
| D. | 元素c和e的气态氢化物的稳定性:c>e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D能形成5种以上单质 | |
| B. | D能分别与A、B、C反应越来越难 | |
| C. | X、Y、Z的稳定性逐渐增强 | |
| D. | B的气态氢化物能与其最高价含氧酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
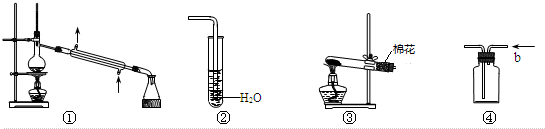
| A. | 装置①可用于除去乙醇中微量的食盐 | |
| B. | 装置②可用于检验CO2气体 | |
| C. | 以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置 | |
| D. | 装置④b口进气可收集H2、N2等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com